История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром или сахаром Сатурна. Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии.
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается Ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.
Мерная таблица уксус в ложке (в граммах)
| Это сколько столовых ложек? | Столовых ложек | Десертных ложек | Чайных ложек |
|---|---|---|---|
| 200 грамм уксуса | 13 | 1 | |
| 200 грамм уксуса | 20 | ||
| 150 грамм уксуса | 10 | ||
| 150 грамм уксуса | 15 | ||
| 100 грамм уксуса | 6 | 1 | |
| 100 грамм уксуса | 6 | 2 | |
| 100 грамм уксуса | 10 | ||
| 100 грамм уксуса | 20 | ||
| 90 грамм уксуса | 6 | ||
| 80 грамм уксуса | 5 | 1 | |
| 75 грамм уксуса | 5 | ||
| 70 грамм уксуса | 4 | 2 | |
| 70 грамм уксуса | 4 | 1 | |
| 65 грамм уксуса | 4 | 1 | |
| 60 грамм уксуса | 4 | ||
| 50 грамм уксуса | 3 | 1 | |
| 45 грамм уксуса | 3 | ||
| 40 грамм уксуса | 2 | 2 | |
| 40 грамм уксуса | 4 | ||
| 40 грамм уксуса | 8 | ||
| 35 грамм уксуса | 2 | 1 | |
| 30 грамм уксуса | 2 | ||
| 30 грамм уксуса | 3 | ||
| 30 грамм уксуса | 6 | ||
| 25 грамм уксуса | 5 | ||
| 20 грамм уксуса | 1 | 1 | |
| 20 грамм уксуса | 2 | ||
| 20 грамм уксуса | 4 | ||
| 15 грамм уксуса | 1 | ||
| 10 грамм уксуса | 1 | ||
| 5 грамм уксуса | 1 |
Мерная таблица уксуса в граммах и миллилитрах «Сколько уксуса в ложке»
| Это сколько столовых ложек? | Столовых ложек | Десертных ложек | Чайных ложек |
| 200 грамм (мл.) уксуса | 13 | 1 | |
| 200 грамм (мл.) уксуса | 20 | ||
| 150 грамм (мл.) уксуса | 10 | ||
| 150 грамм (мл.) уксуса | 15 | ||
| 100 грамм (мл.) уксуса | 6 | 1 | |
| 100 грамм (мл.) уксуса | 6 | 2 | |
| 100 грамм (мл.) уксуса | 10 | ||
| 100 грамм (мл.) уксуса | 20 | ||
| 90 грамм (мл.) уксуса | 6 | ||
| 80 грамм (мл.) уксуса | 5 | 1 | |
| 75 грамм (мл.) уксуса | 5 | ||
| 70 грамм (мл.) уксуса | 4 | 2 | |
| 70 грамм (мл.) уксуса | 4 | 1 | |
| 65 грамм (мл.) уксуса | 4 | 1 | |
| 60 грамм (мл.) уксуса | 4 | ||
| 50 грамм (мл.) уксуса | 3 | 1 | |
| 45 грамм (мл.) уксуса | 3 | ||
| 40 грамм (мл.) уксуса | 2 | 2 | |
| 40 грамм (мл.) уксуса | 4 | ||
| 40 грамм (мл.) уксуса | 8 | ||
| 35 грамм (мл.) уксуса | 2 | 1 | |
| 30 грамм (мл.) уксуса | 2 | ||
| 30 грамм (мл.) уксуса | 3 | ||
| 30 грамм (мл.) уксуса | 6 | ||
| 25 грамм (мл.) уксуса | 5 | ||
| 20 грамм (мл.) уксуса | 1 | 1 | |
| 20 грамм (мл.) уксуса | 2 | ||
| 20 грамм (мл.) уксуса | 4 | ||
| 15 грамм (мл.) уксуса | 1 | ||
| 10 грамм (мл.) уксуса | 1 | ||
| 5 грамм (мл.) уксуса | 1 |
Чаще всего в магазинах можно найти столовый уксус или просто уксус. Наиболее популярные из них это 3%, 6% и 9%. Трех и Шести процентный уксус чаще всего используется для салатов. Девяти процентный (9%) уксус принято использовать для маринадов.
Если вам понравилась наша мерная таблица уксуса, посмотрите пожалуйста нашу самую полную мерную таблицу продуктов питания.
При упоминании об уксусе сразу возникают ассоциации маринованных продуктов – грибов, капусты, лука, огурчиков с помидорами. Как консервант и регулятор кислотности, уксусная кислота широко используется в различных домашних заготовках.
Эта традиционная пищевая добавка часто встречается в рецептах салатов, супов, вторых блюд. Но, добавляя ее «на глаз», можно легко испортить вкус всей еды.
Чтобы быстро отмерить количество специи, указанное в рецепте, надо просто запомнить, сколько уксуса в ложке – столовой, десертной, чайной.
Как быстро разбавить уксусную кислоту 70 до 9: таблица
Влияние уксусной кислоты на организм человека
Уксусный продукт причислен к веществам с третьим классом опасности из-за своей воспламеняемости и опасного воздействия на организм. При любых работах с субстанцией специалисты используют современные средства защиты (противогазы). Даже добавка в пищу Е-260 может быть токсичной для организма, однако степень ее воздействия зависит от концентрации и качества продукта. Опасное влияние уксуса на организм возможно при кислотности выше 30%. Если концентрированная субстанция будет взаимодействовать с кожей/слизистым оболочками, на теле проявятся сильные химические ожоги.
При разумном использовании средства, уксус поможет устранить многие заболевания и косметические дефекты. Так, уксусный продукт применяется для терапии простуды и ревматизма в качестве препарата для растирания. Кислая жидкость, кроме того, оказывает бактерицидный эффект: натуральный антисептик помогает уничтожить грибки и прочую патогенную флору при ангине, фарингите, молочнице. Полезен уксус для волос, поскольку является отличным средством против перхоти. Для кожи жидкость используют при косметических обертываниях и как средство против зуда после укуса насекомых.
- Как убрать низ живота — быстро в домашних условиях. Как убрать низ живота — с помощью упражнений, видео
- Как пить соду по Неумывакину
- Творожная запеканка с яблоками — рецепты с фото. Как приготовить творожно-яблочную запеканку пошагово
Передозировка
Воздействие уксусного продукта на организм человека напоминает влияние азотной, серной или соляной кислот, при этом главное отличие состоит в поверхностной воздействие уксуса. Смертельной для человека дозой продукта является 12 мл: это количества равно примерно стакану столового уксуса или 20-40 мл эссенции. Уксусные пары при попадании в легкие становятся причиной развития пневмонии с осложнениями. Другие симптомы передозировки – это:
- геморрагия печени;
- некроз тканей;
- ожог внутренних органов;
- изъязвление органов ЖКТ;
- нефроз с сопутствующим отмиранием почечных клеток.
Как развести
Чтобы из высококонцентрированной эссенции получить 9% раствор, следует сначала рассчитать общее количество воды в граммах.
Делается это по такой формуле:
- 100 г кислоты умножаем на 70%, делим на 9.
- Из 778 г вычитаем 100.
- Получается 668 г воды.
- Соединяем ее с эссенцией.
Учитывая, что не всем хозяйкам удобно с точностью соблюдать пропорции, можно сделать 9% уксус на глаз. Для приготовления взять 1 часть и 7 частей воды. А для мясного маринада, надо 1 ст. л. уксуса соединить с 1,5 ст. л. дистиллированной жидкостью. На выходе получится 30% раствор.
Интересно! В граненом стакане помещается 17 ст. л. воды. То есть для получения 9% уксуса, необходимо в полный стакан влить 2 ст. л. 70% раствора.
Физические свойства
Ледяная Уксусная кислота
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров.
Абсолютная Уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу.
- Давление паров (в мм. рт. ст.):
- 10 (+17,1 °C)
- 40 (+42,4 °C)
- 100 (+62,2 °C)
- 400 (+98,1 °C)
- 560 (+109 °C)
- 1520 (+143,5 °C)
- 3800 (+180,3 °C)
- Относительная диэлектрическая проницаемость: 6,15 (+20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (+25,2 °C); 0,79 (+50 °C)
- Поверхностное натяжение: 27,8 мН/м (+20 °C)
- Удельная теплоёмкость при постоянном давлении: 2,01 Дж/г·K (+17 °C)
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: +38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | tкип, °C | массовая доля уксусной кислоты |
|---|---|---|
| четырёххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| Бензол | 88,05 | 2 % |
| Толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
-
Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип +88 °C);
- с водой и бутилацетатом (tкип +89 °C).
Концентрация
Органическое вещество, которое производится с помощью процесса брожения, является концентратом уксусной кислоты. Из него получают уксусную эссенцию путем смешивания с водой, а затем разбавляют ее до слабого раствора столового уксуса. Эссенция содержит примерно 70% уксусной кислоты от объема жидкости. Столовый уксус представляет собой ненасыщенный раствор одноименной кислоты, содержание которой в воде может варьироваться от 3 до 15 процентов.
На полках магазинов чаще всего можно встретить уксус 3%, 6% или 9%. Два первых со слабой концентрацией кислоты хороши для приготовления салатов. Вопрос, сколько мл уксуса в столовой ложке 9%, обычно задают хозяйки перед маринованием овощей, мяса или рыбы, а также консервированием, когда им требуется более концентрированный продукт.
Алгоритм подсчета других объемов и веса уксуса
Из школьного курса химии известно, что 1 мл, 1 грамм и 1 куб. мл воды равны по весу и объему. Плотность уксуса близка по значению к похожему свойству воды, поэтому принято считать, что количество граммов и миллилитров при отмеривании пищевой добавки Е260 будет одинаковым. В результате ответ на вопрос, 50 мл или 50 грамм уксуса — это сколько столовых ложек, содержит равное число полных емкостей и заполненных частично.
Для того чтобы строго соблюдать пропорции популярной приправы для любого кулинарного блюда, можно воспользоваться таблицей. Получить в результате желаемый объем приправы (левая колонка таблицы) можно путем объединения значений из центральной колонки, указывающих количество полных столовых ложек, и данных из правой колонки, отражающих численность чайных ложек.
Сколько мл в столовой ложке уксуса? Сколько в чайной ложке уксуса? 50 грамм и 100 мл уксуса – это сколько столовых ложек? Нередко в кулинарные рецепты, особенно ингредиенты заготовок при консервировании овощей на зиму, авторы рецептов включают консервант – уксус либо эссенцию (уксусную).
Уксус, как правило, имеется в каждом доме, но не все хозяйки знают, как дома быстро и без весов отмерить нужную массу уксуса в граммах, объём в миллилитрах при помощи ложек столовых, чайных и обычной десертной ложки.
Сегодня можно купить уксусную эссенцию 70-80% и столовый уксус с самым популярным процентным соотношением уксусной кислоты: 3%, 6%, 9%. Самый слабый уксус – 3% и 6 %, – из этих двух видов готовят заправки для овощных салатов.
Итак, сколько же уксуса содержится в ложке столовой, чайной, десертной? Прежде, чем рассчитывать, сколько вмещается уксуса в ложках различного объёма, необходимо понимать, что такое уксусная кислота, эссенция и сам уксус. Чем отличается кислота от эссенции, есть ли разница между уксусной кислотой и уксусной эссенцией. Многие думают, что эти две жидкости – это одно и тоже вещество, но на самом деле так ли это?
Вкусный рецепт! Йогурт из козьего молока в мультиварке
Что такое ледяная уксусная кислота
Ледяная уксусная кислота (ЛУК) представляет собой органическое соединение, одноосновную кислоту, относящуюся к классу карбоновых кислот.
Это регулятор кислотности, стабилизатор, зарегистрированная официально пищевая добавка Е260, нормы — ГОСТ 61-75.
Области применения:
- производство кондитерских изделий;
- изготовление консервов;
- промышленность;
- фармацевтика;
- парфюмерия.
Хранить дома жидкую ледяную кислоту опасно, так как даже небольшое ее количество при неосторожном применении может вызвать летальный исход
Формула
Синонимы ледяной уксусной кислоты (формула СН3СООН или С2Н4О2) — этановая кислота, уксусная кислота, ЛУК. Acetic acid glaciad — международное название. Это эффективный растворитель органических соединений, который прекрасно смешивается с большинством растворителей, гигроскопична, хорошо растворяется в воде.
Квалификация вещества — «хч», то есть химически чистый (высшая степень чистоты реактива, то есть основной компонент содержится в количестве 99% и более).
ЛУК можно приобрести в аптеке без рецепта в виде:
- субстанции ледяной 1 кг или 1 г;
- субстанции 1 кг.
Получение
Вещество получают микробиологическим (брожение содержащих спирт жидкостей) или химическим (перегонка древесины) способами.
ЛУК получают следующими способами:
- Окисление нефтепродуктов — эффективнейший и самый недорогой из существующих методов.
- Уксуснокислое брожение. При этом как сырье используются жидкости, в составе которых имеется этанол (соки, вино) и кислород с участием ферментов грибков или бактерий.
- Из оксида углерода и ментола (при промышленном производстве).
- Реакция Эмануэля. Суть методики — окисление н-бутана с участием кобальтового катализатора, температуры +200 градусов Цельсия и давления 50 атмосфер.
Свойства уксусной кислоты напрямую зависят от ее концентрации, то есть от содержания воды или примесей.
Концентрация
Применяется в быту и пищевой промышленности как эссенция или уксус. Объясняется подобное легкостью разбавления вещества то нужной концентрации при знании правильных пропорций.
Названия кислоты разные и зависят от концентрации основного вещества:
- уксус — содержит от 3 до 15%;
- эссенция — от 70 до 80%;
- ледяная — является химически чистой (без примесей) или содержит как минимум 96% уксусной кислоты.
Свойства
Ледяная кислота представляет собой кристаллы или жидкость без цвета, имеет очень резкий запах, на вкус кислая. Закипает при температуре +118,1 градуса Цельсия, плавится (то есть кристаллы становятся жидкостью) при +16,75 градуса Цельсия. Очень высокая температура обуславливает самовозгорание ЛУК.
Токсикология
Безводная уксусная кислота — едкое вещество. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Предельно допустимая концентрация в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. А по данным порог восприятия запаха в группе (среднее значение) может достигать 300—500 мг/м3, что значительно превышает ПДК. Причём у отдельных людей он может быть значительно больше среднего значения.
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины.
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена. Смертельная разовая доза составляет примерно 20 мл (при энтеральном приёме в перерасчёте на 100 % кислоту).
Последствиями приёма внутрь концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
В качестве первой помощи при приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог, также кислое содержимое может попасть в дыхательные пути. Допускается в целях нейтрализации кислоты и защиты слизистой приём жжёной магнезии, сырого яичного белка, киселя. Нельзя употреблять в этих целях соду, так как образующийся углекислый газ и вспенивание будет также способствовать забросу кислоты обратно в пищевод, гортань, а также может привести к прободению стенок желудка. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
При ингаляционном отравлении парами требуется ополоснуть слизистые водой или 2 % раствором пищевой соды, приём внутрь молока, слабого щелочного раствора (2 % сода, щелочные минеральные воды) с последующей госпитализацией.
Получение
В промышленности
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана.
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
- 2CH3CHO + O2 ⟶ 2CH3COOH
Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта.
- 2C4H10 + 5O2 ⟶ 4CH3COOH + 2H2O
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола.
Каталитическое карбонилирование метанола
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода, которое происходит по формальному уравнению:
- CH3OH + CO ⟶ CH3COOH
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. Катализатором превращения служил йодид кобальта. Метод заключался в барботаже монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт. Луизиана) и долго оставалась единственным процессом BASF в США.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов
Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO)
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять Этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта.
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением:
-
- CH3CH2OH + O2 → CH3COOH + H2O
Влияние уксуса на организм человека
Опасной для человека дозой служит 1 стакан (200 миллилитров) даже обыкновенного столового уксуса, если его выпить. Ледяной уксусной кислоты хватит 15 г или 20 мл, эссенции — от 20 до 40 мл. При попадании вовнутрь вещество сжигает стенки пищевода, что сопровождается невыносимой болью.
К химическому ожогу приведет попадание на кожу вещества с концентрацией от 30% и больше. Причем поражения могут быть разной степени тяжести. ЛУК при контакте с кожными покровами и слизистой провоцирует необратимый некроз тканей вследствие коагуляции.
Нейтрализовать разрушающее действие поможет незамедлительное и обильное промывание поврежденного участка большим количеством воды с обычным мылом, которое впитает кислоту с образованием хлопьев. Так происходит из-за щелочной реакции среды мыла. После промывания потребуется обработать обожженное место фурацилином или любым другим антисептиком.
Сколько допускается употреблять уксусной кислоты человеку, науке до сих пор не известно. Случаи ухудшения здоровья человека в результате дефицита в рационе этого вещества медицине не известны.
Людям, страдающим язвой, гастритом или другими заболеваниями пищеварительного тракта продукты, содержащие вещество, употреблять не рекомендуется, так как оно раздражает, а иногда и разрушает слизистую. Что обуславливает появление изжоги, а в тяжелых случаях— ожог пищеварительного тракта. Редко, но встречается индивидуальная непереносимость.
Уксус в народной медицине
Альтернативная медицина применяет уксусную кислоту, а точнее ее водный раствор, в качестве лекарства от многих болезней.
Пожалуй, наиболее известный и потребляемый прием – снижение высокой температуры с помощью уксусных компрессов. Однако стоит учитывать, что при таком использовании вещество всасывается в кровь через кожу, что может стать причиной отравления у маленьких детей.
Не менее известное применение этой жидкости при укусах комаров, пчел и других насекомых. С помощью водного раствора кислоты народные целители лечат ангины, фарингиты, артрит, ревматизм, а также грибок стоп и молочницу. Для уменьшения симптомов простуды в комнате, где лежит больной, распыляют уксус. А если участок кожи, обгоревший под солнцем или обожженный медузой, смазать кислым раствором, получится уменьшить неприятные симптомы.
Однако для лечения подойдет не любой уксус. Чаще всего прибегают к яблочному продукту, который содержит в себе много полезных веществ. Кроме уксусной, в нем содержится аскорбиновая, яблочная и молочная кислота. Специфические химические свойства яблочного уксуса делают его средством для лечения артритов. А в комбинации с борной кислотой и спиртом избавляет от повышенной потливости.
Также он важен для снижения холестерина, стабилизации сахара в крови (у диабетиков), избавления от лишнего веса (за счет ускорения метаболизма). Камни в почках альтернативная медицина также выводит уксусной кислотой из яблок.
Всегда стоит учитывать возможный вред в виде развития гастрита, язвы, отравления.
Опасность передозировки
Чаще всего в быту появление ожогов провоцирует 80% эссенция, но иногда достаточно концентрации 30%. Повредить глаза можно 2% раствором. Для органов дыхания опасны пары с концентрацией уксусной кислоты 2%. Ядовитый пар вдыхается легкими, после чего выделяется ими же, что обуславливает возникновение пневмонии.
Передозировка приводит:
- к некротическому нефрозу, при этом клетки почек отмирают;
- острой почечной и печеночной недостаточности;
- геморрагии и токсической дистрофии печени;
- тканевому некрозу.
При вскрытии умершего человека кислота легко обнаруживается благодаря специфическому запаху.
Химические свойства[править | править код]
Уксусная кислота обладает всеми свойствами карбоновых кислот и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты).
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты:
-
- Mg+2CH3COOH→(CH3COO)2Mg+H2↑{\displaystyle {\mathsf {Mg+2CH_{3}COOH\rightarrow (CH_{3}COO)_{2}Mg+H_{2}\uparrow }}}
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:
-
- CH3COOH+Cl2→CH2ClCOOH+HCl{\displaystyle {\mathsf {CH_{3}COOH+Cl_{2}\rightarrow CH_{2}ClCOOH+HCl}}}
Характерные реакции уксусной кислоты
Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
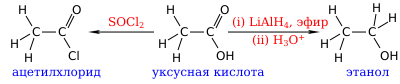
Уксусная кислота может быть восстановлена до этанола действием алюмогидрида лития. Она также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана и карбоната натрия.
Взаимодействует как с растворимыми гидроксидами (щелочами), так и с нерастворимыми гидроксидами
Физические свойства[править | править код]
Ледяная уксусная кислота
Уксусная кислота — это одноосно́вная карбоновая кислота, представляющая собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Смешивается с водой в любых соотношениях, а также со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. В растворах и парах присутствует в виде циклических и линейных димеров.
Абсолютная уксусная кислота называется ледяной, так как при замерзании образует льдовидную массу. Способ получения ледяной уксусной кислоты в 1789 году открыл российский химик немецкого происхождения Товий Егорович Ловиц.
| Давление паров (в мм. рт. ст.): | Температура(°C) |
|---|---|
| 10 | 17,1 |
| 40 | 42,4 |
| 100 | 62,2 |
| 400 | 98,1 |
| 560 | 109 |
| 1520 | 143,5 |
| 3800 | 180,3 |
- Относительная диэлектрическая проницаемость: 6,15 (+20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (+25,2 °C); 0,79 (+50 °C)
- Поверхностное натяжение: 27,8 мН/м (+20 °C)
- Удельная теплоёмкость при постоянном давлении: 2,01 Дж/г·K (+17 °C)
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: +38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | tкип, °C | массовая доля уксусной кислоты |
|---|---|---|
| четырёххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип +88 °C);
- с водой и бутилацетатом (tкип +89 °C).
- Криоскопическая постоянная: 3,6 К кг/моль
Как развести 70 процентный уксус — эссенцию
Если вы хотите получить слабый раствор уксуса, например столовый, но под рукой имеется только уксусная эссенция — не беда. Вы можете легко развести ее водой
, воспользовавшись следующей формулой.
- где
- m — концентрация разбавляемого уксуса в процентах
- n — необходимая концентрация раствора
- V — количество частей воды, которые необходимо добавить на 1 часть разбавляемого уксуса
Воспользовавшись этой формулой определим сколько ложек воды нужно добавить на каждую ложку 70% уксуса, для получения растворов различной концентрации.
| Ложек 70% уксусной эссенции | Ложек воды | Получаемая концентрация |
| 1 | 0,4 | 50% |
| 1 | 0,75 | 40% |
| 1 | 1,3 | 30% |
| 1 | 2,5 | 20% |
| 1 | 6 | 10% |
| 1 | 6,8 | 9% |
| 1 | 7,75 | 8% |
| 1 | 9 | 7% |
| 1 | 10,7 | 6% |
| 1 | 13 | 5% |
| 1 | 16,5 | 4% |
| 1 | 22,3 | 3% |
Будьте внимательны. За результаты онлайн вычислений администрация сайта ответственности не несет. При необходимости произведите проверочные расчеты
Уксусная эссенция — это раствор, состоящий из 20% воды и 80% концентрированной уксусной кислоты. По органолептическим показателям это бесцветная жидкость с резким специфическим запахом и кислым вкусом.
Получают пищевую уксусную эссенцию не соединением кислоты с водой, а путем перегонки 5%-ого уксуса, образующегося естественным образом при скисании вина. Чистую кислоту можно вывести лишь химическим способом с помощью воздействия на ацетаты серной кислотой.
В домашней кулинарии мы чаще сталкиваемся не с самой эссенцией, а с ее водным раствором от 3 до 13%, известным как столовый уксус. Однако для приготовления некоторых маринадов и консервированных изделий требуется именно 70%-ый раствор кислоты. Что же делать, если под рукой его не оказалось? Можно ли и если да, то как заменить уксусную эссенцию 9%-ым уксусом?
Физико-химические свойства
кислота:
-уксусный
-этановая
-этил
коррозионная активность
Ледяная уксусная кислота обладает высокой коррозионной активностью, и ее прием внутрь может привести к серьезным повреждениям пищевода и привратника у человека.
23,70 кДж / моль при 117,9 ºC.
23,36 кДж / моль при 25,0 ° C.
-Раствор с концентрацией 1 М имеет рН 2,4
— Для 0,1М раствора его pH составляет 2,9
— А 3,4 если раствор 0,01М
Химические реакции
Уксусная кислота вызывает коррозию многих металлов, выделяя газ H2 и образование солей металлов, называемых ацетатами. За исключением ацетата хрома (II), ацетаты растворимы в воде. Его реакция с магнием представлена следующим химическим уравнением:
Mg (s) + 2 CH3COOH (ag) => (CH3COO)2Mg (ag) + H2 (G)
При восстановлении уксусная кислота образует этанол. Он также может образовывать уксусный ангидрид при потере воды из двух молекул воды.