Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
|
GB357026A * |
1930-01-06 | 1931-09-17 | Metallgesellschaft Ag | Improvements in or relating to the preparation of phosphoric anhydride and phosphoric acid |
|
SU560896A1 * |
1975-07-15 | 1977-06-05 | Воронежский Ордена Ленина Государственный Университет Им. Ленинского Комсомола | Состав дл растворени красного фосфора |
|
SU701934A1 * |
1977-09-21 | 1979-12-05 | Горьковский Политехнический Институт Им. А.А.Жданова | Способ получени концентрированной смеси азотной и фосфорной кислот |
|
SU1411275A1 * |
1986-12-24 | 1988-07-23 | Казахский Научно-Исследовательский И Проектный Институт Фосфорной Промышленности | Способ получени фосфорной кислоты |
|
RU2209178C1 * |
2002-02-22 | 2003-07-27 | Открытое акционерное общество “РЕАТЭКС” | Способ очистки термической фосфорной кислоты |
Влияние на здоровье человека
Сферы использования продукта
Многие отрасли народного хозяйства по достоинству оценили свойства фосфорной кислоты. Применение её удивительно разносторонне — от научных исследований в молекулярной биологии до обеспечения хладагентами морозильных установок.
Производство минеральных удобрений потребляет львиную долю экстракционной кислоты, и ежегодно сюда расходуется более 90% фосфорсодержащих руд. Растениям фосфор необходим для образования семян и плодов, его добавки увеличивают резистентность к заморозкам и пересушиванию, что особенно существенно для северных областей с коротким периодом вегетации и слабым развитием почвенных микроорганизмов.
Пищевая промышленность заинтересовалась антиоксидантными и стабилизирующими свойствами фосфорной кислоты и успешно применяет их в составе добавки E338. Это предотвращает прогоркание, регулирует кислотность и продлевает сроки годности, придаёт вкус сиропам, газировке, мармеладу, хлебу и другой выпечке. Споры о вреде и пользе таких компонентов ведутся много лет, но альтернативы никто ещё не предложил, и пока что всё сводится только к разумному потреблению.
Металлообработка широко применяет фосфорную кислоту как флюс при пайке меди, чёрных металлов и нержавеющей стали. Очень эффективна также и очистка поверхностей от ржавчины — образуется защитная плёнка, предотвращающая дальнейшую коррозию.
Органический синтез использует H3PO4 как катализатор, авиационная промышленность включила в состав гидрожидкостей, деревообработка пропитывает древесину, делая её негорючей. В этом послужном списке достойно соседствуют звероводство, осветление сахарозы и изготовление лекарств, производство огнеупорных пропиток и стоматология, где фосфорная кислота применяется для протравливания зубных тканей перед пломбированием.
А ещё — получение активированного угля, огнеупорного стекла и керамики, огнезащитных лакокрасочных материалов, огнестойкого фосфатного пенопласта и древесно-стружечных плит. Соли фосфаты используются для умягчения жёсткой водопроводной воды и входят в состав СМС и средств, удаляющих накипи.

Основные способы получения
Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2H2O = 3H3PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4H3PO3 = 3H3PO4 + PH3.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6H2O = 4H3PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:
IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода. Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.
Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.
При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:
Дигидратные (CaSO4·2H2O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств. Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
Гемигидратные (CaSO4·0,5H2O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода H2SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
приложений
Фосфатные соли и общее использование
-Фосфорная кислота служит основой для выработки фосфатов, которые используются в качестве удобрений, потому что фосфор является основным питательным веществом растений.
-Он использовался для лечения отравления свинцом и других состояний, при которых требуются значительные количества фосфатов, и для производства легкого ацидоза.
-Используется для контроля pH мочевых путей норки и расходов во избежание образования камней в почках.
-Фосфорная кислота образует соли Na2HPO4 и NaH2ПО4 которые составляют буферную систему для рН с рКа 6,8. Эта регуляторная система рН присутствует у человека, что имеет значение для регуляции внутриклеточного рН, а также для управления концентрацией водорода в дистальных канальцах и коллекторе нефронов..
-Он используется для удаления заплесневелого слоя оксида железа, который накапливается на этом металле. Фосфорная кислота образует фосфат железа, который легко удаляется с поверхности металла. Он также используется при электрической полировке алюминия и является связующим веществом для огнеупорных изделий, таких как глинозем и магнезия..
промышленные
-Фосфорная кислота предназначена в качестве каталитического агента при производстве нейлона и бензина. Он используется в качестве дегидратирующего агента в литографической гравировке, в производстве красителей для использования в текстильной промышленности, в процессе коагуляции латекса в резиновой промышленности и в очистке перекиси водорода..
-Кислота используется в качестве добавки в безалкогольных напитках, тем самым способствуя ее вкусу. Разбавленный применяется в процессе рафинирования сахара. Он также действует как буферная система при приготовлении ветчины, желатина и антибиотиков..
-Участвует в разработке моющих средств, в кислотном катализе производства ацетилена.
-Он используется в качестве подкислителя в сбалансированном корме для животноводства и домашних животных. Фармацевтическая промышленность использует его в производстве противорвотных лекарств. Это также используется в смеси, чтобы сделать асфальт, чтобы проложить землю и восстановить трещины.
-Фосфорная кислота действует как катализатор в реакции гидратации алкенов с образованием спирта, главным образом этанола. Кроме того, он используется при определении органического углерода в почвах..
стоматологический
Он используется стоматологами для очистки и кондиционирования поверхности зуба перед установкой зубных опор. Он также находит применение при отбеливании зубов и при удалении зубных бляшек. Кроме того, он используется при изготовлении адгезивов для зубных протезов..
косметика
Фосфорная кислота используется для корректировки рН при приготовлении косметических средств и для ухода за кожей. Используется в качестве химического окислителя для производства активированного угля..
Осторожность и безопасность при производстве и использовании ортофосфорной кислоты
Хранение
Ортофосфорная кислота является очень коррозионной и опасной химической веществом. Необходимо хранить ее в специальных флаконах или контейнерах, которые она не разъест. Также следует хранить кислоту в темном и прохладном месте, не подверженном воздействию солнечных лучей или высокой температуре.
Использование
При использовании ортофосфорной кислоты необходимо соблюдать все меры предосторожности. Никогда не держите кислоту в своих руках, не нюхайте ее и не вдыхайте ее пары
Опасно также проливать кислоту на кожу или одежду. При разбавлении кислоты необходимо добавлять ее в воду, а не наоборот. Используйте только защитные очки и перчатки, чтобы избежать burns и damage to eyes.
Утилизация
После использования ортофосфорной кислоты она должна быть утилизирована правильно. Нельзя просто выкинуть кислоту в мусорное ведро или смешивать ее с другими химическими веществами. Лучше всего обратиться к специальным службам по утилизации опасных химических веществ или к местным химическим заводам для правильной утилизации кислоты.
Где применяется
ФОСФОРНАЯ-ОРТО КИСЛОТА
ОБЩИЕ СВЕДЕНИЯ
Ортофосфорная кислота (синоним: кислота фосфорная) представляет собой бесцветную жидкость, плотностью от 1,56г/см3 (для кислоты концентрацией 73%) до 1,71г/см3 (для кислоты концентрацией 87%), не имеющую запаха. Очень хорошо растворима в воде. Обычно ортофосфорной кислотой называют 85%-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях. Химическая формула H3PO4.
НОРМАТИВНАЯ ДОКУМЕНТАЦИЯ
ГОСТ 6552-80, ГОСТ 10678-76, CAS: 7664-38-2
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
ПДК (по фосфорному ангидриду) в воздухе рабочей зоны производственных помещений составляет 1 мг/м3. При увеличении концентрации пары ортофосфорной кислоты вызывают атрофические процессы слизистых оболочек и крошение зубов, а также воспалительные заболевания кожи.
При работе с препаратом следует применять индивидуальные средства защиты (респиратор, резиновые перчатки, защитные очки), а также соблюдать правила личной гигиены.
Помещения, в которых проводятся работы с препаратом, должны быть оборудованы общей приточно-вытяжной вентиляцией. Анализ препарата следует проводить в вытяжном шкафу лаборатории.
УПАКОВКА, МАРКИРОВКА, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
Ортофосфорную кислоту фасуют в стеклянную и полимерную тару, устойчивую к воздействию кислот. Фасовку проводят в чистую герметичную, проверенную и признанную годной к эксплуатации тару.
Расчет уровня заполнения тары проводят с учетом полного использования ее вместимости и объемного расширения продукта при возможном перепаде температур в пути следования.
Допускается заливать ортофосфорную кислоту в специализированные контейнеры средней грузоподъемности (полимерная емкость в металлическом каркасе), изготовленные по нормативным документам или технической документации.
Препарат упаковывают и маркируют в соответствии с ГОСТ 3885.
Транспортная маркировка по ГОСТ 14192 с нанесением знаков опасности по ГОСТ 19433.
Для каждой квалификации продукта на этикетку рекомендуется наносить цветную полосу:
желтую – для особо чистых веществ;
красную – для реактивов х.ч.;
синюю – для реактивов ч.д.а.;
зеленую – для реактивов ч.
На тару наносят знак опасности по ГОСТ 19433 (класс 8, подкласс 8.1, черт.8, классификационный шифр 8113), серийный номер ООН 1805.
Ортофосфорную кислоту перевозят всеми видами транспорта в соответствии с правилами перевозки грузов, действующими на данном виде транспорта.
Препарат хранят в упаковке изготовителя в крытых отапливаемых складских помещениях.
ПРИМЕНЕНИЕ
Ортофосфорная кислота используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
В авиационной промышленности используется в составе гидрожидкостей НГЖ-5У и её иностранных аналогов.
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках, например в Кока-Коле.
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов.
Производство фосфорной кислоты
В небольших количествах фосфорная кислота легко получается в лабораторных условиях при окислении фосфора раствором 32-процентной азотной кислоты. В промышленных условиях она получается посредствам экстракционного и термического способа.
Экстракционный способ считается менее затратным. Суть его заключается в разложении природных фосфатов при помощи различных кислот, наиболее часто применяемыми является серная, а также азотная и соляная. Данный метод подразумевает экстрагирование P2O5 в следующий вид — H3PO4. Для этих целей фосфаты подвергаются обработке H2SO4, а полученная пульпа фильтруется от осевшего сульфата Ca. Таким образом, получается чистая ортофосфорная кислота.
К сырью, применяемому при производстве фосфорной кислоты, предъявляется перечень довольно высоких требований, так, например, природные фосфаты, содержащие в большом количестве карбонаты, соединения Al, Mg, Fe и иные органические вещества — непригодны! На территории Российской Федерации и стран СНГ при производстве фосфорной кислоты чаще всего используется Хибинский апатитовый концентрат наряду с фосфоритами Каратау.
Термический способ, используемый для получения наиболее чистой кислоты, состоит из нескольких этапов: сжигание элементного фосфора, гидратация P4O10 и абсорбция его водой, конденсация и улавливание газа. В зависимости от применяемого принципа охлаждения газов, встречается три вида проведения термического получения кислоты:
• испарительный;
• циркуляционно-испарительный;
• теплообменно-испарительный.
Отечественные предприятия чаще всего прибегают к использованию технологии с циркуляционно-испарительным методом охлаждения.
§ 39. Кислородсодержащие соединения фосфора
Фосфорная кислота
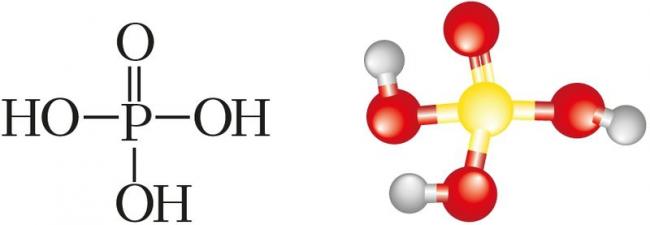
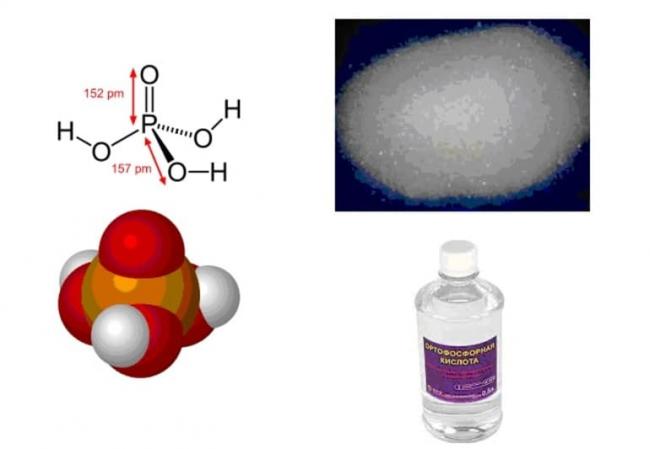
Химические и физические свойства. Фосфор образует несколько кислот, однако самой устойчивой является фосфорная кислота H3PO4 (рис. 96). Из структурной формулы её молекулы видно, что кислота трёхосновна. H3PO4 — вещество, температура плавления которого 42,35 °С. Это означает, что при комнатной температуре фосфорная кислота — твёрдое вещество. Фосфорная кислота хорошо растворима в воде. В водном растворе диссоциирует ступенчато:
Фосфорная кислота — слабый электролит, диссоциирует преимущественно по первой ступени. В растворах она проявляет общие свойства кислот: меняет цвет индикаторов и образует соли в реакциях с металлами, находящимися в ряду активности до водорода (1), основными и амфотерными оксидами (2), гидроксидами металлов и аммиаком (3), другими солями (4); она не является окислителем за счёт аниона:
| 1 |
металл |
| 2 |
3СаO + 2H3PO4 = Сa3(PO4)2↓ + 3H2O оксид основный 3ZnO + 2H3PO4 = Zn3(PO4)2↓ + 3H2O оксид амфотерный |
| 3 |
3NaOH + H3PO4 = Na3PO4 + 3H2O; основание (щёлочь) 2NН3 + H3PO4 = (NН4)2HPO4 аммиак |
| 4 |
соль |
Отметим, что фосфорная кислота образует как средние соли (фосфаты), так и кислые (гидрофосфаты и дигидрофосфаты), в зависимости от соотношения исходных веществ. Например:
3КOH + H3PO4 = К3PO4 + 3H2O (фосфат калия) (3 : 1);
2КOH + H3PO4 = К2HPO4 + 2H2O (гидрофосфат калия) (2 : 1);
КOH + H3PO4 = КН2PO4 + H2O (дигидрофосфат калия) (1 : 1).
При составлении уравнений реакций в ионной форме фосфорную кислоту представляют в виде молекул как преобладающих частиц в её растворе. Например:
Применение и получение. Фосфорную кислоту применяют в производстве удобрений и кормовых средств, для формирования антикоррозионных покрытий на металлах, а также в пищевой промышленности для придания кисловатого вкуса безалкогольным напиткам, для осветления сахара.
Получают H3PO4 взаимодействием природных фосфатов с серной кислотой при 60‒80 °С с последующим отфильтровыванием осадка СаSO4. При этом фосфорная кислота образуется в виде сиропообразного раствора с массовой долей вещества 85 %. Второй способ — сжигание фосфора, полученного прокаливанием природного фосфата с песком и углём, и последующее растворение оксида в воде:
Сa3(PO4)2 → Р → P2O5 → H3PO4.
Соли фосфорной кислоты. Фосфаты, как правило, нерастворимы, за исключением солей натрия, калия и аммония. Кислые соли более растворимы, чем средние, а дигидрофосфаты имеют большую растворимость, чем гидрофосфаты. Например, фосфат Ca3(PO4)2 нерастворим, гидрофосфат CaHPO4 — мало растворим, а дигидрофосфат Ca(H2PO4)2 — хорошо растворим в воде.
Большинство фосфатов обладает высокой термической устойчивостью — не разрушаются при нагревании до температуры плавления. Характерной особенностью фосфатов (средних солей) является образование осадка жёлтого цвета при действии раствора нитрата серебра(I) (Приложение 3):
В отличие от светло-жёлтого осадка бромида серебра(I) и жёлтого осадка йодида серебра(I), фосфат серебра(I) растворяется при добавлении азотной кислоты.
Применение солей фосфорной кислоты. Многие средние и кислые соли фосфорной кислоты (Ca3(PO4)2, CaHPO4 · 2H2O, Ca(H2PO4)2 · H2O, NН4H2PO4, (NН4)2HPO4) используются в качестве удобрений. Фосфаты находят применение в производстве каучука, пластмасс, в металлургии. Фосфат натрия уменьшает жёсткость воды и улучшает моющее действие стиральных порошков. Тем не менее во многих государствах в настоящее время установлены ограничения по применению фосфатов в качестве стиральных моющих средств. Дело в том, что после стирки фосфаты попадают в сточные воды, а затем в водоёмы, способствуя бурному развитию планктона и водорослей — водоёмы «стареют». По некоторым данным, 1 г фосфата стимулирует рост 5–10 кг водорослей.
свойства
Внешний вид
В твердой форме он представляет собой ромбические, гигроскопичные и прозрачные кристаллы. Под жидкой формой это кристаллическое появление вязкого сиропа.
Коммерчески это достигается в водном растворе с концентрацией 85% мас. / Мас. Во всех этих презентациях отсутствует запах.
158º C (316ºF до 760 мм рт. Ст.).
108º F (42,2º C).
кислотность
рН: 1,5 (0,1 н раствор в воде)
рКа: рКа1 = 2,148; рКа2 = 7,198 и рКа3 = 12,319. Следовательно, его водород плюс кислота является первым.
разложение
При нагревании выделяет оксиды фосфора. Если температура поднимается до 213 ° C или выше, она превращается в пирофосфорную кислоту (H4P2О7).
Образование фосфорной кислоты
-Фосфорную кислоту получают из фосфатных пород апатитового типа путем расщепления концентрированной серной кислотой:
Калифорния3(РО4)2 + 3 ч2SW4 + 6 ч2O => 2 H3ПО4 + 3 (CaSO4.2H2O)
Фосфорная кислота, полученная в этой реакции, имеет низкую чистоту, поэтому она подвергается процессу очистки, который включает методы осаждения, экстракции растворителем, кристаллизации и ионного обмена..
-Фосфорная кислота может быть получена путем растворения пятиокиси фосфора в кипящей воде.
-Его также можно получить, нагревая фосфор смесью воздуха и водяного пара:
P4 (л) + 5 О2 (г) => Р4О10 (S),
P4О10 (s) + H2O (г) => 4H3ПО4 (Л)
Вопрос-ответ:
Какие ингредиенты нужны для приготовления ортофосфорной кислоты?
Для приготовления ортофосфорной кислоты достаточно иметь фосфатную руду, серную кислоту и спирт. Руда должна быть предварительно измельчена.
Как долго нужно кипятить смесь, чтобы получить ортофосфорную кислоту?
Смесь нужно кипятить приблизительно 6-7 часов, изредка помешивая. Точное время зависит от конкретных условий приготовления.
Как определить концентрацию ортофосфорной кислоты?
Концентрацию можно определить с помощью pH-метра или индикаторных бумажек. Не рекомендуется определять концентрацию на глаз.
Как хранить ортофосфорную кислоту?
Ортофосфорную кислоту нужно хранить в темном и прохладном месте, защищенном от солнечного света и непосредственных тепловых источников. Хранение должно происходить в стеклянных или полипропиленовых емкостях.
Как опасен процесс приготовления ортофосфорной кислоты?
Приготовление ортофосфорной кислоты является опасным процессом, требующим соблюдения особых мер предосторожности. Необходимо соблюдать все правила безопасности в процессе работы с химическими веществами
Какие присадки можно добавить в ортофосфорную кислоту?
К ортофосфорной кислоте можно добавлять различные присадки, например, красители или ароматизаторы. Но не стоит забывать о том, что это может повлиять на химические свойства кислоты.
Можно ли использовать ортофосфорную кислоту для домашних химических экспериментов?
Ортофосфорную кислоту можно использовать для домашних химических экспериментов, но только при соблюдении всех правил безопасности.
Применение
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Стоматология
Ортофосфорная кислота применяется для протравливаня (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется протравливание эмали зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4 и 5 поколения стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6 и 7 поколения отдельный этап протравливания кислотой отсутвует. Так адгезивы являются самопротравливающимися. Хотя некоторые производители все же рекомендуют для усиления адгезии кратковременно протравливать эмаль и при использовании самопротравливащих адгезивов.
Физические свойства:
| 200 | Физические свойства | |
| 201 | Плотность | |
| 202 | Температура плавления | |
| 203 | Температура кипения | |
| 204 | Температура сублимации | |
| 205 | Температура разложения* | |
| 206 | Температура самовоспламенения смеси газа с воздухом | |
| 207 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 208 | Удельная теплота испарения (энтальпия кипения ΔHкип) | |
| 209 | Удельная теплоемкость при постоянном давлении | |
| 210 | Молярная теплоёмкость | |
| 211 | Молярный объём | |
| 212 | Теплопроводность | |
| 213 | Коэффициент теплового расширения | |
| 214 | Коэффициент температуропроводности | |
| 215 | Критическая температура | |
| 216 | Критическое давление | |
| 217 | Критическая плотность | |
| 218 | Тройная точка | |
| 219 | Растворимость в воде и иных жидкостях | |
| 220 | Давление паров (мм.рт.ст.) | |
| 221 | Давление паров (Па) | |
| 222 | Стандартная энтальпия образования ΔH | |
| 223 | Стандартная энергия Гиббса образования ΔG | |
| 224 | Стандартная энтропия вещества S | |
| 225 | Стандартная мольная теплоемкость Cp | |
| 226 | Энтальпия диссоциации ΔHдисс | |
| 227 | Диэлектрическая проницаемость | |
| 228 | Магнитный тип | |
| 229 | Точка Кюри | |
| 230 | Температура Нееля | |
| 231 | Объемная магнитная восприимчивость | |
| 232 | Удельная магнитная восприимчивость | |
| 233 | Молярная магнитная восприимчивость | |
| 234 | Электрический тип | |
| 235 | Электропроводность в твердой фазе | |
| 236 | Удельное электрическое сопротивление | |
| 237 | Сверхпроводимость при температуре | |
| 238 | Критическое магнитное поле разрушения сверхпроводимости | |
| 239 | Запрещенная зона | |
| 240 | Концентрация носителей заряда | |
| 241 | Твёрдость по Моосу | |
| 242 | Твёрдость по Бринеллю | |
| 243 | Твёрдость по Виккерсу | |
| 244 | Скорость звука | |
| 245 | Поверхностное натяжение | |
| 246 | Динамическая вязкость газов и жидкостей | |
| 246 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 247 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 248 | Предел прочности на растяжение | |
| 249 | Предел текучести | |
| 250 | Предел удлинения | |
| 251 | Модуль Юнга | |
| 252 | Модуль сдвига | |
| 253 | Объемный модуль упругости | |
| 254 | Коэффициент Пуассона | |
| 255 | Коэффициент преломления |
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
-
- (дигидрофосфат натрия)
- (гидрофосфат натрия)
- (фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Ортофосфорная кислота. Фосфаты
Ключевые слова конспекта: ортофосфорная кислота, фосфаты
Высшими гидроксидами фосфора являются фосфорные кислоты: ортофосфорная H3РO4, метафосфорная НРО3 и дифосфорная Н4Р2O7.
Ортофосфорная кислота – вещество молекулярного строения. В безводном состоянии образует бесцветные гигроскопичные легкоплавкие (t°пл = 42 °С) кристаллы. Смешивается с водой в любых соотношениях.
Ортофосфорная кислота – слабый электролит, диссоциирует ступенчато:
Ортофосфорная кислота проявляет общие свойства кислот. Она взаимодействует:
а) с основаниями:
б) с основными и амфотерными оксидами:
в) с солями более слабых и летучих кислот:
В отличие от азотной кислоты, ортофосфорная может образовать кислые соли:
2КОН + H3РO4 = К2НРO4 + 2H2OилиКОН + H3РO4 = КH2РO4 + H2O
Окислительные свойства осуществляются только за счёт иона водорода. Однако реакции со многими металлами замедляются из-за образования нерастворимых фосфатов. Например, магний реагирует с фосфорной кислотой, но скорость реакции постепенно уменьшается вследствие образования нерастворимого фосфата на поверхности магния:
При нагревании ортофосфорная кислота теряет воду, превращаясь в дифосфорную кислоту, а затем в полифосфорные кислоты:
2H3РO4 = Н4Р2O7 + H2O
ФОСФАТЫ
Ортофосфорная кислота – трёхосновная, образует три ряда солей: средние – фосфаты Xn(PO4)m (X – катион металла), кислые – гидроортофосфаты Xn(HPO4)m (X – катион металла или NH4+) и дигидроортофосфаты Х(H2РO4)n (X – катион металла или NH4+, n = 1; 2).
Фосфаты – вещества с ионным типом кристаллических решёток, при обычных условиях – твёрдые кристаллические вещества. Фосфаты могут быть окрашены только за счёт катионов металлов. Средние фосфаты плохо растворимы в воде (растворимы только фосфаты Na, К, Rb, Cs), гидрофосфаты и особенно дигидрофосфаты гораздо лучше растворимы в воде. Средние ортофосфаты плавятся без разложения при нагревании при достаточно высоких температурах.
В водных растворах средних фосфатов обязательно происходит гидролиз:
Поэтому водные растворы средних фосфатов имеют щелочную реакцию.
Для фосфатов, в отличие от нитратов, не характерны окислительные свойства, несмотря на то что фосфор находится в высшей степени окисления. Этому способствует симметричная тетраэдрическая структура иона РО43–.
Однако восстановление фосфора в высшей степени окисления +5 возможно. Примером такой реакции может служить промышленное получение фосфора:
Одной из качественных реакций на фосфаты является образование жёлтого осадка при взаимодействии с растворимыми солями серебра:
Конспект урока химии «Ортофосфорная кислота. Фосфаты».
Следующая тема: «».
Образование фосфорной кислоты
-Фосфорную кислоту получают из фосфатных пород апатитового типа путем разложения концентрированной серной кислотой:
Ca 3 (PO 4 ) 2 + 3 H 2 SO 4 + 6 H 2 O => 2 H 3 PO 4 + 3 ( CaSO 4 · 2H 2 O)
Фосфорная кислота, полученная в этой реакции, имеет низкую чистоту, поэтому она подвергается процессу очистки, который включает методы осаждения, экстракции растворителем, кристаллизации и ионного обмена.
-Фосфорную кислоту можно получить растворением пятиокиси фосфора в кипящей воде.
-Его также можно получить, нагревая фосфор смесью воздуха и водяного пара:
P 4 (l) + 5 O 2 (g) => P 4 O 10 (s)
P 4 O 10 (т) + H 2 O (г) => 4H 3 PO 4 (л)
Оксид фосфора (III) P2O3 и фосфористая кислота H3PO3
Оксид фосфора (III) — типичный кислотный оксид. Это значит, он способен реагировать с водой с образованием соответствующей кислоты и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами.
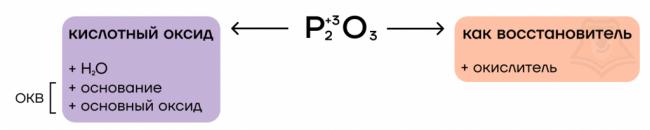
За счет степени окисления +3 оксид фосфора (III) проявляет восстановительные свойства, повышая в реакциях степень окисления до +5.
- Реакция с водой
Как типичный кислотный оксид, P2O3 способен взаимодействовать с водой с образованием соответствующего гидроксида (кислоты).
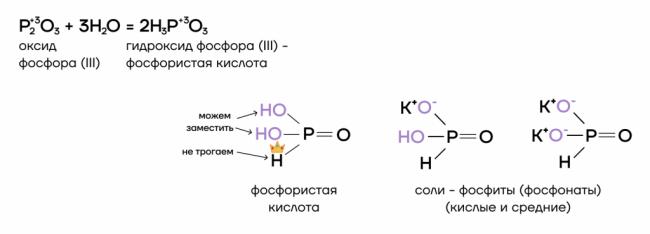
- Основно-кислотное взаимодействие
Тут все очень просто! P2O3 — кислотный оксид, он проявляет кислотные свойства. Значит, он способен вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами — с образованием солей.
Безопасное обращение с фосфорной кислотой
Безопасный душ и фонтанчики для аварийной промывки глаз должны быть доступны в непосредственной близости от потенциального воздействия химического вещества.
При использовании фосфорной кислоты должна быть обеспечена соответствующая вентиляция, а при необходимости должна быть установлена местная вытяжная вентиляция.
Средства индивидуальной защиты (СИЗ), такие как защитные очки с боковыми щитками, защитная одежда, фартуки, перчатки и маски, всегда необходимы при работе с кислотными химикатами.
Также следует избегать ношения контактных линз с фосфорной кислотой, поскольку они способны поглощать часть химического вещества из воздуха.
Chemwatch имеет самую большую коллекцию паспортов безопасности в мире. Для копия ChemwatchSDS для фосфорной кислоты, нажмите кнопку ниже.
Скачать SDS
Безопасность фосфорной кислоты
Контакт с глазами – основная форма воздействия фосфорной кислоты.
Хотя фосфорная кислота является распространенным и безопасным ингредиентом в продуктах питания и напитках, при чрезмерном потреблении она будет токсичной для человеческого организма, и рвоту не следует вызывать. Если человек находится в сознании, ему следует дать воды для полоскания рта и предупредить врача.
В случае попадания на кожу; снять загрязненную одежду, обувь и аксессуары и промыть пораженный участок большим количеством воды. Перед повторным ношением загрязненную одежду необходимо обеззаразить.
Если кислота попала в глаза человеку, промывайте их пресной проточной водой в течение не менее 30 минут, не забывая промывать глаза под веками. Обратитесь к медицинскому работнику.
Если путь воздействия – вдыхание, пострадавшего следует переместить к источнику свежего воздуха и контролировать в случае возникновения симптомов.
Хаpaктеристика
Ортофосфорная или фосфорная кислота отличается неорганическим происхождением. При комнатной температуре она имеет вид маленьких ромбовидных кристаллов. Чаще всего она продается в виде сироповидного восьмидесяти пятипроцентного раствора с отсутствием запаха и цвета. Ее ромбические кристаллы хорошо растворяются в воде или этаноле. Получается в результате гидролиза пентахлорида фосфора, из фосфата, взаимодействием оксида фосфора (V) с водой.
Основное ее свойство — это оказывать влияние на кислотно-щелочной баланс в организме человека, что приводит к повышению кислотности. Повышенная кислотность, способствует формированию кариеса и преждевременного остеопороза. В больших концентрациях она вызывает кровотечение из носа, повреждение слизистой носа, разрушает зубы и трaнcформирует формулу крови. Она взаимодействует с металлами, основными оксидами, основаниями, аммиаком, солями слабых кислот.