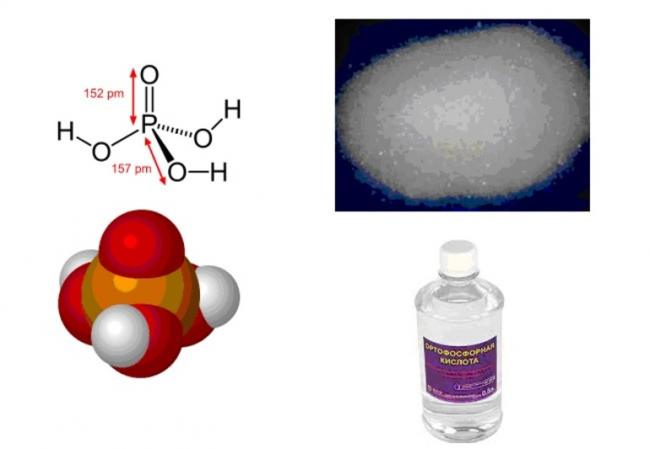
Физические свойства
Фосфорная (ортофосфорная) кислота с молярной массой 97,99 г/моль и эмпирической формулой H3PO4 — неорганическая трёхосновная кислота средней силы. Структурная формула молекулы в газообразном агрегатном состоянии описывается в виде тетраэдра, содержит в центре атом фосфора, а в вершинах — атом кислорода и три гидроксильные группы.
Состав следующий:
| Наименование | Количество атомов | Массовая доля, % |
| Водород (H) | 3 | 3,10 |
| Фосфор (P) | 1 | 65,30 |
| Кислород (O) | 4 | 31,60 |
При нормальных условиях бесцветные кристаллы гигроскопичны, плавятся на воздухе уже при 42,35 °C, легко растворяются в воде, этиловом спирте и других растворителях. Практическое применение имеют водные растворы трёх видов:
| Концентрация, % | Температура плавления, °C | Плотность, грамм/мл |
| 75 | -20 | 1,579 |
| 80 | 1,633 | |
| 85 | +20 | 1,689 |
Сиропообразная жидкость без цвета и запаха 85%-й концентрации H3PO4 обычно и называется ортофосфорной кислотой, а кипячением в вакууме при 80 °C из неё выделяется безводная составляющая. В твёрдой фазе и в высококонцентрированных растворах молекулы фосфорной кислоты образуют межмолекулярные водородные связи.

Использует
Большая часть производимой фосфорной кислоты предназначена для производства фосфорных удобрений ; это также сырье для производства моющих средств.
Удобрение
Титр ( P 2 O 5 ) чистой фосфорной кислоты составляет 72,45%; однако коммерчески доступны продукты в водном растворе с титром обычно от 52 до 60.
Еда
Он используется в качестве добавки в пищевой промышленности, особенно в газированных напитках (особенно коле ) в качестве регулятора кислотности, но не без разногласий относительно его воздействия на здоровье. Добавка, по сути, являясь химическим соединением, производимым в массовом порядке, доступна по очень низким ценам и в больших количествах. Вот почему лимонную кислоту часто заменяют лимоном и лаймом . Его идентификационный код по правилам Евросоюза – E 338 .
Врачи
Фосфорная кислота используется в стоматологии в виде раствора для очистки и придания шероховатости поверхности зубов, в местах наложения пломб или зубных протезов. Он также используется во многих зубных пастах или средствах для отбеливания зубов. Он также входит в состав препаратов против тошноты.
Гидравлическое производство
Он также используется для получения гидровых кислот, поскольку фосфорная кислота реагирует с солями натрия с образованием соответствующих гидровых кислот.
Антикоррозийный
Фосфорную кислоту можно использовать для удаления ржавчины (оставляя металл чистым). Продукты, содержащие фосфорную кислоту, можно использовать в качестве «преобразователя ржавчины» путем непосредственного нанесения на ржавчину, металлические предметы или поверхности. Фосфорная кислота превращает оксид железа (III) (ржавчину) в фосфат железа (III), FePO 4 , который имеет черный цвет. «Преобразователь ржавчины» часто представляет собой зеленоватую жидкость, подходящую для погружения в обрабатываемые материалы, но чаще он имеет форму геля . После обработки фосфат железа (черный) можно соскоблить, оставив чистую поверхность. Для удаления всей ржавчины может потребоваться многократное применение фосфорной кислоты. Фосфорно-железную чернь можно оставить там, где она продлит антикоррозийный эффект.
Маркетинг
В продажу поступает в виде водного раствора концентрацией до 80%, так как получить его в чистом виде затруднительно. Он также хорошо растворяется в этаноле .
Литература[править | править код]
- Букколини Н. В. Фосфорная кислота // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 153–156. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия. 1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter. — Vol.24,№ 11. — 2000. —P.1—2.
Примечания
- Исилио Гуарески , ( PDF ), на liberliber.it , Турин, Unione Tipografico-Editrice, 1915.
- Н. Н. Гринвуд и А. Эрншоу, Фосфор , в Химия элементов , 2-е изд., Баттерворт-Хайнеманн, 1997, с. 518, ISBN 0750633654 .
- М. Дж. Баргер-Люкс, Р. П. Хини и М. Р. Стегман, Влияние умеренного потребления кофеина на экономию кальция у женщин в пременопаузе [опубликованные опечатки появляются в Am J Clin Nutr, 1991, январь; 53 (1): 182] , в Am J Clin Nutr , vol. 52, н. 4, 1990, с. 722-725, PMID .
- Fertilizer International, май-июнь 2008 г., статья, стр. 81, «Надежная альтернатива процессу влажной фосфорной кислоты»
Фосфатирование металлических поверхностей
Фосфатирование – это процесс покрытия поверхностей черных либо цветных металлов тонкой пленкой, защищающей ее от образования ржавчины и улучшающей адгезию с окрасочным составом.
Применение такой технологии позволяет значительно улучшить устойчивость к износу контактирующих деталей в узлах трения. Метод может быть реализован практически для всех сплавов, кроме высоколегированной стали – на ней появляется фосфатная пленка недостаточно высокого качества.
Для чего выполняется фосфатирование?
Фосфатирование металла перед покраской выполняется в целях обеспечения поверхности надежной защитой от коррозионных процессов в местах, очищенных от старой краски и ржавчины механическим способом. Перед нанесением защитного слоя металлические конструкции или изделия необходимо тщательно очистить от пыли и грязи, а также обезжирить.
Такой способ защиты конструкций из металла допускает их эксплуатацию в условиях:
- воздействия автомобильных масел и топлива;
- в электроустановках до 1 кВ;
- высокой влажности;
- в средах с органическими растворителями;
- нахождения под лакокрасочным покрытием.
Образующаяся пленка способна надежно защитить металл в указанных выше условиях, но быстро разрушается в агрессивных кислотной и щелочной средах. Потому перед выполнением фосфатирования нужно определить состав среды, в которой будет эксплуатироваться металлическое изделие.
Применение[править | править код]
Удаление ржавчины
Плюсом использования ортофосфорной кислоты для химической очистки ржавчины является то, что она не только убирает рыхлую массу окислов, но и создает тонкую защитную пленку. Механизм создания такой защиты заключается в том, что кислота, разъедая и поглощая оксид железа, фосфатирует поверхность. Те, кто работал с этим веществом, могли наблюдать, что после обработки металла и высыхания на его поверхности, на месте рыжего налета, образуется сероватая пленка, масляная на ощупь.
В зависимости от степени коррозии и размера очищаемой детали или изделия можно выбрать разные способы удаления окислов:
- травление детали с полным погружением в раствор;
- одно- или многократная обработка кислотой поверхности валиком или пульверизатором;
- нанесение на металл с предварительной механической очисткой.
Основные способы получения
Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2H2O = 3H3PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4H3PO3 = 3H3PO4 + PH3.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6H2O = 4H3PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:
- IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода. Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
- TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.
- Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.

При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:
- Дигидратные (CaSO4·2H2O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств. Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
- Гемигидратные (CaSO4·0,5H2O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
- Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.

Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода H2SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Производство
Существует три способа получения ортофосфорной кислоты.
Термический процесс
Фосфорная кислота, полученная с помощью этого процесса, очень чистая. Его получают сжиганием элементарного фосфора с образованием пятиокиси фосфора и растворением его в разбавленной фосфорной кислоте. Фосфор перед сжиганием должен быть очищен в печи от любых посторонних примесей, образующихся при его добыче. Для использования кислоты в пищевых продуктах необходимы дальнейшие процессы для удаления любых соединений мышьяка.
Мокрый процесс
Мокрый процесс производит фосфорную кислоту путем добавления сильной кислоты (например , серной кислоты , азотной кислоты или соляной кислоты ) к фосфатным породам и минералам, в основном к апатиту Ca 5 (PO4) 3 . Упрощенная реакция выглядит следующим образом:
Эту кислоту можно очистить, удалив фтор, чтобы ее можно было использовать для животных или пищевых продуктов всегда после удаления любых соединений мышьяка.
Печной метод
Технология KPA (Kiln Posphoric Acid) является одной из самых последних. Эта технология, получившая название «Улучшенный жесткий процесс» , увеличит извлечение P 2 O 5 из запасов фосфатов. Это может значительно увеличить доступность этого соединения.
Другие методы
Прямая реакция между белым фосфором и кислородом дает фосфорный ангидрид P 2 O 5 , который затем гидратируется до метафосфорной кислоты , пирофосфорной кислоты и ортофосфорной кислоты в порядке увеличения гидратации.
Как получают фосфорную кислоту
Химическая формула данного вещества — H3PO4. Ее получают в лабораторных условиях из фосфора двумя способами
- Экстракционный способ. Ортофосфорная кислота получается после разложения фосфатов двух других кислот: серной (данную реакцию еще называют сернокислотной) и фосфорной. В результате образуется H3PO4 и нерастворимый CaSO4, которые разделяют с помощью фильтров.
- Термический способ. Фосфор сжигают до состояния фосфорного ангидрида (P4O10), который затем путем гидратации превращается в ортофосфорную кислоту.
Полученные в результате одной из двух реакций кристаллы растворяют в воде. В зависимости от концентрации кислоты образуется 73% или 85% желтовато-зеленая жидкость без запаха, которая разливается в специальную тару и надежно закупоривается. Вещество имеет 8 класс опасности, поэтому его нужно хранить в хорошо проветриваемом помещении без доступа к пищевым продуктам и кормам для животных.
Меры предосторожности
При необходимости удаления ржавчины химическим путем в первую очередь нужно позаботиться о своей безопасности – подготовить респиратор и резиновые перчатки. Фосфорная кислота – это агрессивное вещество, которое может вызвать ожоги кожных покровов, а ее испарения – ожоги дыхательных путей и острое отравление. Кроме того, она пожаро- и взрывоопасна.
Все работы должны выполняться в хорошо проветриваемых помещениях, при этом нельзя допускать попадания вещества на кожу. Если это произошло, нужно промыть пораженный участок под проточной водой. При химическом ожоге на большой площади необходимо сразу же обратится в лечебное учреждение.
Общие характеристики
Название «фосфорная кислота» обычно относится к ортофосфорной кислоте; префикс орто- используется, чтобы отличить его от других фосфорных и полифосфорных кислот. Широко используется в сельском хозяйстве в качестве удобрения.
Ортофосфорная кислота представляет собой коррозионную, но нетоксичную трипротонную неорганическую кислоту средней силы. В чистом виде при комнатной температуре и давлении это кристаллическое твердое вещество ( моноклинные кристаллы ), которое плавится до42,36 °C в чрезвычайно вязкой бесцветной жидкости . В нем сосуществуют различные балансы, два основных из которых — частичная дегидратация пирофосфорной (дифосфорной) кислотой и быстрый и экстенсивный аутопротолиз :
Влияние на здоровье человека
Различные сферы применения ортофосфорной кислоты
Она широко применяется в сельском хозяйстве, а также пищевой промышленности из-за полезных свойств при умеренном добавлении.
В сельском хозяйстве ее используют для удобрения почвы, что помогает растениям пережить засуху и низкие температуры.
Почва становится более плодородной и пригодной для выращивания овощей и мелкой зелени
В пищевой промышленности данный состав используется в качестве пищевой добавки и регулятора кислотности. Её активно добавляют в газированные напитки, колбасные изделия, сыры и так далее. До сих пор ведутся споры о вреде добавления этого вещества в продукты питания, но пока она официально разрешена.
Раствор также применяется при пайке для скрепления деталей из стали или меди. Используется для растворения и припоя оксидной пленки на поверхность предмета. Кислотное соединение размягчает эту пленку, а затем на ее месте образуется новая, которая препятствует появлению ржавчины. Используйте этот трюк при строительстве или сооружении чего-либо, чтобы избавиться от возможных проблем с коррозией.
Свое применение данное кислотное соединение нашло также в электронике, а именно аккумуляторах, так как является электролитом средней силы. Она затормаживает рост вредных кристаллов соли внутри аккумулятора, продлевая его срок действия.
Узнайте, чем лучше склеить пластмассовые детали.
Преимущества ортофосфорной кислоты для удаления ржавчины
- Ортофосфорная кислота хорошо удаляет ржавые налеты на эмалевых и фаянсовых изделиях, на металлической поверхности, активно используется в автомобильной промышленности.
- С помощью такого средства можно удалить ржавчину, не натирая поверхность, это помогает сохранить эмаль.
- Ортофосфорная кислота образует на очищенном месте пленку, которая служит защитой поверхности от нового образования коррозии, и других повреждений.
- Такую кислоту можно использовать для очищения ванн, унитазов и умывальников, а также других бытовых приборов, имеющих аналогичную поверхность.
- Ортофосфорная кислота помогает вывести ржавые пятна, и в дальнейшем защитить поверхность от повреждения коррозией.
При работе с кислотой, необходимо надевать средства защиты, респиратор и перчатки, так как вещество является агрессивным. Перед нанесением кислоты, поверхность необходимо обезжирить с помощью моющих составов, затем хорошо промыть водой, а после этого распылять кислоту. По истечении необходимого времени, кислоту смывают нейтральным раствором на основе спирта, нашатыря и воды. После этого поверхность промывают водой и высушивают. Если слой ржавчины слишком толстый, то его предварительно очищают металлической щеткой или болгаркой со специальной насадкой. Работу необходимо выполнять в правильной последовательности, если пропустить хотя бы одно действие, это приведет к некачественному очищению.
Как правильно хранить и перевозить ортофосфорную кислоту
Ортофосфорная кислота является агрессивным средством, поэтому необходимо соблюдать определенные правила при перевозке и хранении этого вещества. Порошок должен быть помещен в герметичную тару. Чтобы в кислоту не попадали посторонние элементы, все емкости должны использоваться в чистом и сухом виде, тогда приготовленный раствор будет иметь высокое качество.
Приготовление некачественного состава грозит опасным отравлением парами или отсутствием желаемого результата. Хранят емкости с кислотой в сухом и теплом месте, где отсутствует сырость и появление конденсата. Не нужно пересыпать порошок в другую емкость, лучше оставить её в первоначальной упаковке. Такой груз считается опасным, поэтому для его перевозки на дальние расстояния, понадобиться специальная документация.
Биохимия
Ортофосфорная кислота и фосфаты широко распространены в биологии, особенно в соединениях, происходящих из фосфорилированных сахаров , таких как ДНК , РНК или АТФ .
Биологические эффекты
Фосфорная кислота, используемая во многих напитках, была связана эпидемиологическими исследованиями со снижением плотности костей. Например, исследование с использованием рентгеновских пластин, несмотря на обычные опросники переломов, приводит к важным доказательствам в поддержку теории. Это исследование было опубликовано в Американском журнале клинического питания . Всего в исследовании приняли участие 1672 женщины и 1148 мужчин в период с 1996 по 2001 год. Информация о диетах была собрана с помощью анкеты (в которой также указывалось количество потребляемой колы с разделением на классическую, легкую и без кофеина). Исследование выявило важные статистические данные о женщинах, которые ежедневно употребляли колу. Исследование также предложило дальнейшие исследования для подтверждения результатов.
С другой стороны, исследование, проведенное Pepsi , показало, что недостаточное поступление фосфора может привести к снижению плотности костей. В исследовании изучалось не влияние фосфорной кислоты, которая в пищеварительном тракте связывается с магнием и кальцием , образуя соли, которые не могут усваиваться организмом человека, а влияние фосфора .
Однако авторитетное клиническое исследование Хини и Рафферти с использованием метода баланса кальция не обнаружило влияния на экскрецию кальция, вызванного приемом газированных напитков, содержащих фосфорную кислоту . В исследовании сравнивалось влияние воды, молока и других напитков (два с кофеином и два без кофеина; два с фосфорной кислотой и два с лимонной кислотой) на баланс кальция у женщин в возрасте от 20 до 40 лет, которые выпивали около 3 и более стаканов в день. (680 мл) этих напитков. Они обнаружили, что только молоко и два напитка с кофеином влияли на содержание кальция в моче, и что потеря кальция по сравнению с напитками с кофеином была примерно такой же, как ранее при приеме только кофеина (отсюда употребление кофе). В заключение Хини и Рафферти заявили, что эффект газированных напитков, в том числе с кофеином и фосфорной кислотой, оказывает незначительное влияние на кальций и что влияние этих напитков на скелет в основном связано с недостатком молока.
Потребление колы также было связано с хроническими проблемами почек и камнями в почках .
ссылки
- Королевское химическое общество. (2015). Фосфорная кислота. Взято из: chemspider.com
- Канадский центр гигиены и безопасности труда. (1999). Фосфорная кислота – Влияние на здоровье. Взято из: ccsso.ca
- Acidos.Info. (2018). Фосфорная кислота “Разновидности использования этого химического соединения”. Получено из: acidos.info
- Джеймс П. Смит, Уолтер Э. Браун и Джеймс Р. Лер. (1955). Структура кристаллической фосфорной кислоты. J. Am. Chem. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Фосфорные кислоты и фосфаты. Взято из: en.wikipedia.org
- Наука это весело. Узнайте о фосфорной кислоте. . Взято из: scifun.chem.wisc.edu
Химические свойства
Растворы H3PO4 имеют различный ионный состав, зависящий от кислотности (pH) среды. Как и для всех среднесильных трёхосновных кислот, электролитическая диссоциация фосфорной кислоты является трёхступенчатой, по первой ступени реакция экзотермическая и сопровождается выделением тепла, а по второй и третьей — эндотермическая:
- H3PO4 = H+ + H2PO4-.
- H2PO4- = H+ + HPO42-.
- HPO42- = H+ + PO43-.
При комнатной температуре H3PO4 ведёт себя достаточно инертно, при нагревании проявляет кислотные свойства средней силы и изменяет цвет индикаторов на красный. Она реагирует с металлами, стоящими в ряду активности до водорода: 3Al + 2H3PO4 = Al3 (PO4)2 + 3H2. Вступает в реакции нейтрализации с гидроксидами: 3NaOH + H3PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2H3PO4 = Mg3 (PO4)2 + 3H2O.
Нагревание выше 80 °C способствует взаимодействию с пассивными оксидами и силикатами. Поэтому в металлургии широко применяется процесс фосфатирования: защитная плёнка фосфатов образуется на поверхности чугунных, стальных или медных изделий, улучшая их характеристики. Повышение температуры приводит к дегидратации молекулы с образованием пирофосфорной и метафосфорной кислоты:
- 2H3PO4 = H2O + H4P2O7;
- H4P2O7 = H2O + 2HPO3.

Дальнейшее нагревание увеличивает длину цепи, и в результате образуются полифосфорные кислоты (НРО3) n с полимерным строением. Одна только ортофосфорная кислота взаимодействует с нитратом серебра, образуя ярко-жёлтый осадок, тогда как остальные дают белый: H3PO4 + 3AgNO3 = Ag3PO4 + 3HNO3. Поэтому осаждение фосфата серебра служит качественной реакцией на фосфат-ион.