Содержание
Фосфорную кислоту получают из фосфата:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обpaбатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО4 3− является образование ярко-жёлтого осадка молибденофосфата аммония:
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
(дигидрофосфат натрия) (гидрофосфат натрия) (фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Что такое фосфорная кислота?
Фосфорная кислота представляет собой неорганическую минеральную кислоту без цвета и запаха.
Химическая формула фосфорной кислоты H₃PO₄. Она также называется ортофосфорной кислотой.
Это может быть жидкое, либо прозрачное кристаллическое твердое вещество, вызывающее коррозию металлов, а также тканей человека.
Другие факты об этой кислоте (особенно для любителей науки):
- Фосфорная кислота р = 1,5
- Плотность фосфорной кислоты = 1,8741
- Температура кипения фосфорной кислоты = 158 ° C
- Заряд фосфорной кислоты = 0
Почему фосфорная кислота содержится в коле и других употребляемых продуктах? Производителям продуктов питания и напитков фосфорная кислота нравится. Потому что она дешевая, добавляет терпкость и действует как консервант.
Пищевая промышленность продолжает включать фосфатные добавки в продукты питания. Например, разлитый по бутылкам черный чай может стать напитком с высоким содержанием фосфатов из-за добавок производителя.
Газированные напитки темного цвета, такие как кола, обычно содержат больше, чем другие газированные напитки. Один контейнер с содой может содержать до 500 миллиграммов этой кислоты. Исключением является пиво темного цвета. Оно обычно содержит очень мало этой кислоты.
Почему производители продуктов питания и напитков вообще используют этот химикат? Они используют его для придания своим обработанным продуктам более острого и танжерный вкуса.
Плюс, она также действует как консервант.
Есть много распространенных применений фосфорной кислоты. Это соединение содержится в коле, разлитых по бутылкам и консервированных чаях со льдом, кофейных напитках, батончиках из хлопьев для завтрака. А также в немолочных сливках и в улучшенных куриных и мясных продуктах.
Использование фосфорной кислоты в пищевых продуктах и напитках является законным. А также разрешается регулировать уровень pH в плавленых сырах и других молочных продуктах.
На этикетках фосфорная кислота может быть обозначена следующим образом:
- E338
- ортофосфорная кислота
- фосфорная (V) кислота
- пирофосфорная кислота
- трифосфорная кислота
- о-фосфорная кислота
- гидрофосфат
Научные исследования подтверждают, что прием этой кислоты может иметь ряд возможных последствий для здоровья. Хотя существует много распространенных видов применения фосфорной кислоты.
Ортофосфорная кислота для металла
Учитывая, что существует несколько вариантов очищения металла с применением ортофосфорного соединения, следует рассмотреть каждый из них подробнее.
Очищение с полным погружением очищаемой детали, к примеру, требует предварительного очищения детали от жиров любого происхождения. Для этого достаточно промыть металлическое изделие при помощи любого моющего средства. Далее нужно растворить в одном литре воды 150 мл кислоты. После того, как раствор будет готов нужно опустить в него деталь на один час. При этом требуется постоянно размешивать раствор, чтобы кислота лучше действовала.
Читать еще: Можно ли есть горох при похудении
После того, как кислота оказала свое действие, и ржавчина растворилась, необходимо смыть ортофосфорную кислоту при помощи специального раствора, составе которого имеется 50 частей воды, 2 части нашатырного спирта, 48 частей спирта.
Окончанием процедуры станет ополаскивание детали проточной водой и сушка.
Если металлическое изделие по причине его больших размеров нельзя погрузить в контейнер, то тут можно применить другой способ удаления ржавчины. Для этого нужно нанести ортофосфорную кислоту при помощи распылителя, валика или обычной кисти на поверхность металла. В некоторых случаях, возможно, потребуется предварительная ручная очистка ржавчины. После того, как часть ржавчины буквально отодрана с поверхности металлического изделия, на металл наносится раствор кислоты, выдерживается определенное время, после чего изделие омывается нейтрализующим кислоты раствором и производится его сушка.
В обоих случаях при необходимости можно увеличивать период воздействия кислоты на окислы металла.
Возможно применение ортофосфорной кислоты и при необходимости очистки домашних унитазов, ванн и paковин. Но следует запомнить, что не стоит применять ортофосфорную кислоту, как и другие виды кислот для очищения акриловых сантехнических элементов.
Фаянсовые и эмалированные поверхности можно очистить следующим способом. Предварительно обезжиренную любым моющим средством поверхность обpaбатывают кислотным раствором. Для его приготовления нужно взять и перемещать 1 литр воды с 200 гр фосфорной кислоты. В зависимости от степени загрязнения кислоту нужно оставить на поверхности на 1-12 часов. По истечении времени кислоту нужно нейтрализовать раствором соды и смыть.
Завод «Пигмент» увеличивает объемы выпуска акриловых эмульсий и сульфаминовой кислоты
На протяжении трех кварталов нынешнего года на модернизацию техпроцессов и оснащения ПАО «Пигмент» (Тамбов) потратил более 366 млн рублей. Проекты по наращиванию мощности реализуются в производствах акриловых эмульсий и сульфаминовой кислоты. В цехах по производству пигментов, отбеливателей и полуфабрикатных лаков проводятся работы по улучшению качественных хаpaктеристик материалов, применяются новые технологии.
В Кургане начнут выпускать емкости для трaнcпортировки соляной кислоты
В ходе реализации планов по импортозамещению на производственных площадках завода «Курганхиммаш» впервые в нашем государстве выпущена партия офшорных танк-контейнеров. Тара изготавливается из нержавеющей стали толщиной 6 мм, внутренняя поверхность которых покрыта особым материалом для защиты от действия агрессивных сред. Данные емкости позволяют хранить и трaнcпортировать соляную кислоту под давлением не выше 0,4 МПа при температурах окружающей среды от –40 до +500 °С.
Применение лакокрасочных материалов
Применение ЛКМ обусловлено различными требованиями. Но наиболее распространенные – это для декоративной отделки и для защиты различных материалов от нeблагоприятных воздействий для сохранения их долговечности.
Цель
Префикс «мета», тоже греческое слово, означает «после». Его добавляют к тем веществам, формула которых исключила молекулу, в данном случае молекулу воды:
H 3 PO 4 => HPO 3 + H 2 O
Обратите внимание, что на этот раз добавление двух фосфорных звеньев не происходит с образованием дифосфорной кислоты, а вместо этого получается метафосфорная кислота (для которой нет доказательств ее существования)
Также важно отметить, что эту кислоту можно описать как H 2 O · P 2 O 5 (аналог гемидрата, умножение HPO 3 на 2). Мета-префикс идеально сочетается с циклическими ПА, поскольку, если трифосфорная кислота дегидратируется, но не добавляет еще одно звено H 3 PO 4, чтобы стать тетрафосфорной кислотой, тогда она должна образовывать кольцо
Мета-префикс идеально сочетается с циклическими ПА, поскольку, если трифосфорная кислота дегидратируется, но не добавляет еще одно звено H 3 PO 4, чтобы стать тетрафосфорной кислотой, тогда она должна образовывать кольцо
Также важно отметить, что эту кислоту можно описать как H 2 O · P 2 O 5 (аналог гемидрата, умножение HPO 3 на 2). Мета-префикс идеально сочетается с циклическими ПА, поскольку, если трифосфорная кислота дегидратируется, но не добавляет еще одно звено H 3 PO 4, чтобы стать тетрафосфорной кислотой, тогда она должна образовывать кольцо
То же самое и с другими полиметафосфорными кислотами, хотя IUPAC рекомендует называть их циклическими соединениями соответствующих ПА.
Правила транспортировки ортофосфорной кислоты
Фосфорная кислота относится к агрессивным веществам, поэтому порошок необходимо размещать в изолированной таре
Важно не допускать попадания в кислоту посторонних веществ. Емкости под хранение и перевозку вещества должны быть сухими и чистыми
Только при соблюдении указанных требований можно получить раствор надлежащего качества. Если же состав получится некачественным, велика вероятность выделения вредных паров. Кроме того, с помощью низкокачественного раствора не выйдет защитить металл.
Хранить тару с порошком нужно в теплом и сухом месте. Необходимо избегать сырых мест, где возможно образование конденсата. Не рекомендуется пересыпать порошок в другую тару, желательно хранить его в изначальной упаковке. Поскольку груз относится к опасным веществам, для перемещения его на значительные расстояния понадобится сопроводительная документация.
Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной H3PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.
Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.
Предыдущая запись Валентные электроны — правила, формулы и примеры определения
Следующая запись Марганец (Mn) — формула, строение и свойства химического элемента
Влияние на здоровье человека
Удаление ржавчины с поверхности ванн, унитазов и умывальников
Ортофосфорную кислоту можно использовать и в качестве бытовой химии. Она прекрасно справляется с очисткой следов ржавой воды в унитазах и эмалированных ваннах. Не подходит это средство лишь для акриловых ванн.
Применение для фаянсовых и эмалированных поверхностей:
- 100 г 85%-й кислоты нужно добавить на 500 мл воды;
- обезжирить поверхность любым моющим средством;
- щеткой с натуральным ворсом обработать загрязненную поверхность;
- через несколько часов (от 1 до 12 – зависит от накоплений окислов) смыть кислоту раствором соды – 1 ст. ложка на литр воды.
Преимущества такого способа очистки ржавчины – не приходится ничего тереть, поэтому не нарушается эмаль. Информация для хозяек, которые для очистки рыжего налета используют «Кока-колу»: именно ортофосфорная кислота, присутствующая в небольшом количестве в этом напитке, дает такой результат. Гораздо эффективнее использовать действующее вещество в нужной пропорции, а напитки применять по назначению.
Свойства
H3PO4 — трёхосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например ClO4.
В водных растворах подвергается электролитической диссоциации в три стадии с образованием катиона гидроксония. Степень диссоциации и вид зависят от pH раствора:
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра, при этом образуется жёлтый осадок:
H 3 P O 4 + 3 A g N O 3 → A g 3 P O 4 + 3 H N O 3 {\displaystyle {\mathsf {H_{3}PO_{4}+3AgNO_{3}\rightarrow Ag_{3}PO_{4}+3HNO_{3}}}}
Качественной реакцией на ион H2РО4− является образование ярко-жёлтого осадка молибденофосфата аммония:
H 3 P O 4 + 12 2 M o O 4 + 21 H N O 3 → 3 P M o 12 O 40 ⋅ 6 H 2 O ↓ + 21 N H 4 N O 3 + 6 H 2 O {\displaystyle {\mathsf {H_{3}PO_{4}+12_{2}MoO_{4}+21HNO_{3}\rightarrow _{3}PMo_{12}O_{40}\cdot 6H_{2}O\downarrow +21NH_{4}NO_{3}+6H_{2}O}}}
Степень диссоциации ортофосфорной кислоты в зависимости от кислотности раствора.
Применение от ржавчины
Преобразователь ржавчины на основе ортофосфорной кислоты создает на поверхности защитный слой, оберегающий от коррозии при дальнейшем использовании. Особенность применения соединения – безопасность для металла при нанесении. Существует несколько способов выполнить удаление ржавчины ортофосфорной кислотой, зависящих от размера повреждения:
- травление с погружением в ванну, иную емкость;
- многократное нанесение на металл состава пульверизатором, валиком;
- покрытие поверхности предварительно обработанной механической очисткой.
Ортофосфорное соединение производит преобразование ржавчины в фосфаты железа. Состав можно использовать для промывки и очистки:
- изделий металлопроката;
- скважин;
- поверхностей трубопроводов;
- парогенераторов;
- систем водоснабжения, отопления;
- змеевиков;
- бойлеров;
- водонагревателей;
- теплообменников;
- котлов;
- деталей машин и механизмов.
Тип вещества
Пищевая добавка E 338 — это приятное на вкус неорганическое (минеральное) вещество. Классифицируется как антиоксидант. Используется преимущественно в роли подкислителя.
Получают ортофосфорную кислоту двумя способами:
- Экстракционный. Экономически выгодный, наименее трудоемкий. Природные фосфаты обрабатывают кислотами (чаще серной, иногда соляной, редко азотной). Поучившуюся пульпу очищают от осадков.
- Термический. Многоступенчатый цикл дает наиболее чистый продукт. На первой стадии элементный фосфор сжигают до фосфорного ангидрида. Затем абсорбируют кислотой, конденсируют и охлаждают.
Пищевой ортофосфорной кислотой принято называть ее 85% раствор.
Антиоксидант Е 338 является синтетическим.
Фосфаты: другие риски для здоровья
Однако, специалисты предостерегают людей со здоровыми почками от любых фосфатных добавок и призывает к всестороннему просвещению населения, а также к четкой маркировке добавок на соответствующих продуктах питания. В экспериментах на животных фосфатные добавки оказались веществами, ускоряющими возникновение возрастных жалоб. Помимо остеопороза, это также включает жалобы со стороны мышц и кожи, а также преждевременную кальцификацию сосудов сердца.
Это особенно верно в отношении синтетических фосфатов. Встречающиеся в природе фосфаты (например, в бобовых, орехах, или злаках) присутствуют в значительно меньших количествах и не полностью усваиваются организмом. Организм может гораздо эффективнее использовать искусственные добавки, благодаря чему уровень фосфатов быстро повышается.
Во избежание этого следует употреблять фаст-фуд только в умеренных количествах.
Правила безопасности при работе с кислотой
Средство относится к разряду опасных веществ, что накладывает свой отпечаток не только на методы транспортировки и хранения, но и требует соблюдения норм безопасности во время работы. Так как это кислота, то она может разъедать многие материалы и вызывать возникновения ожогов на кожных покровах. Поэтому работать с ортофосфорной кисл
отой можно только в специальной одежде, которая защитит кожу от попадания на нее опасных веществ.
Не стоит забывать о парах, которые также очень опасны. Попадая в организм при вдохе, они вызывают серьезные ожоги дыхательных путей
Каждому человеку, имеющему дело с такими веществами, очень важно знать порядок действий при попадании их на кожу
- В первую очередь следует сразу же снять всю одежду, если на нее попало вредное вещество.
- Промыть пострадавший участок кожи большим количеством воды, желательно проточной, на протяжении минимум 15 минут.
- Нельзя втирать это средство в кожу, вытирать его салфетками.
- Если промывание водой не помогает, то его стоит продлить еще минут на 15. Это же действие необходимо повторить, когда жжение возобновляется через какое-то время после промывания.
- Чтобы не усугублять положение, до приезда скорой помощи необходимо защитить пострадавший участок от окружающей среды, наложив для этого свободную марлевую повязку.
- Можно выпить обезболивающее. Оптимальным препаратом является Анальгин.
Фосфатные соли и общее применение
-Фосфорная кислота служит основой для производства фосфатов, которые используются в качестве удобрений, поскольку фосфор является основным питательным веществом для растений.
-Он использовался при лечении отравления свинцом и других состояний, при которых требуется значительное количество фосфата и при возникновении легкого ацидоза.
-Используется для контроля pH мочевыводящих путей норок и расходов во избежание образования камней в почках.
-Фосфорная кислота дает соли Na 2 HPO 4 и NaH 2 PO 4, которые составляют буферную систему pH с pKa 6,8. Эта система регулирования pH присутствует у человека и играет важную роль в регулировании внутриклеточного pH, а также в управлении концентрацией водорода в дистальных и собирающих канальцах нефронов.
-Он используется для удаления плесневого слоя оксида железа, который накапливается на этом металле. Фосфорная кислота образует фосфат железа, который легко удаляется с поверхности металла. Он также используется при электрической полировке алюминия и является связующим для огнеупорных материалов, таких как оксид алюминия и магнезия.
Физические свойства
В чистом виде фосфорная кислота представляет собой бесцветное кристаллическое вещество с температурой плавления 42,35 °С. Кристаллы имеют моноклинную сингонию. Твёрдая фосфорная кислота гигроскопична и расплывается на воздухе; она смешивается с водой во всех соотношениях, но коммерчески обычно доступна в трёх концентрациях:
- 75 % H3PO4 (т. пл. –20 °С);
- 80 % H3PO4 (т. пл. 0 °С);
- 85 % H3PO4 (т. пл. 20 °С).
Из 85 %-ой фосфорной кислоты можно получить безводную при испарении воды в вакууме при 80 °С. Из концентрированных растворов она осаждается в виде гемигидрата H3PO4·0,5H2O.
В твёрдом состоянии и концентрированных растворах между молекулами фосфорной кислоты существуют водородные связи. При снижении концентрации до 40-50 % более устойчивой является водородная связь между фосфат-анионами и молекулами воды. Также в растворах фосфорная кислота обменивается атомами кислорода с водой.
Сферы применения фосфорной кислоты
Современная наука довольно часто позволяет использовать одно и то же химическое вещество или один и тот же химический состав в совершенно различных целях. То же самое можно сказать и о вариантах применения ортофосфорной кислоты.
На сегодняшний день, существует немалое количество разнообразных сфер применения ортофосфорной кислоты. Так, к примеру, данную кислоту могут применять при органическом синтезе. Применяют ее в случаях, когда требуется создать фосфорные соли натрия, кальция, алюминия, марганца.
Велико значение и использование ортофосфорной кислоты в промышленности по металлобработке, поскольку тут практически незаменима ортофосфорная кислота, влияние которой доказано при удалении ржавчины или предотвращении ее появления.
Ортофосфорную кислоту можно обнаружить и в составе большого количества веществ, предназначенных для использования хозяйками в быту. Известно и об ее использовании в медицинской и пищевой промышленности.
Среди прочих сфер, где можно обнаружить применение ортофосфорной кислоты, можно назвать:
- Нефтяную промышленность,
- Изготовление спичек,
- Изготовление кинопленки,
- Производство противопожарных или огнеупорных предметов и материалов.
Велика роль ортофосфорной кислоты и в процессе подпитки растений, поскольку широко известно, благотворное влияние фосфора на способность растений давать высокие урожаи. Сельскохозяйственные культуры благодаря этой кислоте приобретают устойчивость к заморозкам и прочим неблагоприятным условиям.
Значение ортофосфорной кислоты важно и для животных. Она не только совместно с другими органическими веществами участвует в метаболических процессах животного организма, но еще и помогает в образовании у некоторых видов животных панцирей и других естественных наростов, поскольку в их составе имеется фосфат кальция
Применяется ортофосфорная кислота и в виде пищевой добавки в некоторых продуктах питания. Она имеет код Е 338. Свое назначение в пищевой промышленности данная кислота находит в производстве колбас, некоторых видов плавленых сыров, газированных напитков.
Следует отметить, что не стоит злоупотреблять продуктами питания, в составе которых отмечено присутствие ортофосфорной кислоты, поскольку не выяснено какова норма потребления ее человеком в сутки. Но в любом случае польза от ее потребления несоизмеримо мала, если даже не сказать, ничтожна, в сравнении с тем вредом, который она может нанести в виде нарушения работы желудочно-кишечного тракта, возникновения кариеса, развития остеопороза.
Рекомендации по очищению изделий ортофосфорной кислотой
Очищение производят с осторожностью, чтобы металлическая поверхность не стала слишком тонкой, и не образовались дыры. Во время предварительного очищения механическим путем, нельзя использовать диски с крупными элементами, иначе можно нанести значительный вред поверхности
Перед началом основной работы, остальную поверхность необходимо закрыть пленкой, так как в результате воздействия такого сильного средства может повредиться остальное покрытие. Поэтому обработку необходимо выполнять аккуратно, чтобы не пришлось реставрировать испорченную поверхность, это приведет к дополнительным расходам.
Если работа произведена правильно, то в результате получается надежная и прочная поверхность, не содержащая ржавых пятен, которые приводят к разрушению металлических изделий.
При нанесении ортофосфорной кислоты на поверхность, необходимо надевать перчатки и респиратор, они служат средствами защиты от вредного вещества. В случае попадания кислоты на одежду, её нужно немедленно снять, чтобы средство не попало на кожу, и не оставило ожог.
https://youtube.com/watch?v=WoZe0x8HRYw
Где применяется
промышленные
-Фосфорная кислота используется в качестве катализатора при производстве нейлона и бензина. Он используется в качестве дегидратирующего агента при литографической гравировке, в производстве красителей для использования в текстильной промышленности, в процессе коагуляции латекса в резиновой промышленности и при очистке от перекиси водорода.
-Кислота используется в качестве добавки в безалкогольные напитки, тем самым улучшая их вкус. Разбавленный применяется в процессе рафинирования сахара. Он также действует как буферная система при приготовлении ветчины, желатина и антибиотиков.
-Участвует в разработке моющих средств, в кислотном катализе производства ацетилена.
-Он используется в качестве подкислителя в сбалансированных кормах для животноводства и домашних животных. Фармацевтическая промышленность использует его при производстве противорвотных препаратов. Он также используется в смеси для изготовления асфальта для мощения земли и ремонта трещин.
-Фосфорная кислота действует как катализатор в реакции гидратации алкенов с образованием спирта, в основном этанола. Кроме того, он используется для определения органического углерода в почвах.
Как получают фосфорную кислоту
Как она производится?
Фосфорная кислота может быть синтезирована либо мокрым способом, либо термическим способом способ достижения какой-либо цели.
В последнем в качестве сырья используются воздух, вода и элементарный фосфор. Он включает в себя три важных этапа понятие, имеющее следующие значения: пункт для ночлега, отдыха и питания проходящих (передвигающихся) по военным дорогам войсковых частей (воинских частей), команд, оборудованный участок пути: сгорание, увлажнение и запотевание. Вот как это происходит:
Во-первых, жидкий элементарный фосфор сжигается в камере сгорания сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе экзотермических реакций, сопровождающийся интенсивным выделением тепла при высоких температурах физическая величина, характеризующая термодинамическую систему и количественно выражающая интуитивное понятие о различной степени нагретости тел в диапазоне от 1650 до 2760 °C. Эта реакция действие, возникающее в ответ на какое-либо воздействие окисления происходит в окружающем воздухе смесь газов, главным образом, азота и кислорода ( 98—99 % ) в сумме и зависит от влажности (концентрации водяного пара), а также аргона, углекислого газа, водорода, образующая земную атмосферу и производит пятиокись фосфора.
4P + 5O 2 -> 2 P 2 O 5
Затем продукт гидратируют водой с образованием система воспитания и обучения личности, а также совокупность приобретаемых знаний, умений, навыков, ценностных установок, функций, опыта деятельности и компетенций сильной фосфорной кислоты (в жидком состоянии).
P 2 O 5 + 6 H 2 O -> 2 P 2 O 5
На последнем этапе для удаления фосфорно-кислотного тумана из потока дымовых газов используются высоконапорные каплеуловители.
Концентрация фосфорной кислоты, синтезированной в этом процессе, обычно составляет от 75 до 85 процентов. Такие уровни концентрации необходимы для производства высококачественной химической продукции. Несколько эффективных установок извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя тот же тепловой процесс.
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота химические соединения , способные отдавать катион водорода (кислоты Брёнстеда), либо соединения, способные принимать электронную пару с образованием ковалентной связи (кислоты Льюиса) обрабатывается природным фосфатсодержащим минералом следует путать с минеральными добавками (биологически значимые элементы, биологически активные добавки), таким как гидроксиапатит.
Ca 5 (PO 4 ) 3 OH + 5 H 2 SO 4 -> 3 H 3 PO 4 + 5 CaSO 4 + H 2 O
Минерал высушивают, крошат, а затем подают в реактор вместе с серной парнокопытное млекопитающее из подсемейства козьих семейства полорогих, обитающее в Европе и Малой Азии кислотой. В результате или Итог (русскоязычный вариант) — последствие цепочки (череды) действий или событий, выраженных качественно или количественно реакции сульфат сливается с кальцием (из минерала), образуя сульфат соли серной кислоты H2SO4, а также (в органической химии) полные эфиры серной кислоты (диалкилсульфаты R−O−SO2−O−R) и алкилсульфаты — соли алкилсерных кислот HSO3OR кальция элемент второй группы (по старой классификации — главной подгруппы второй группы), четвёртого периода, с атомным номером 20 (гипс).
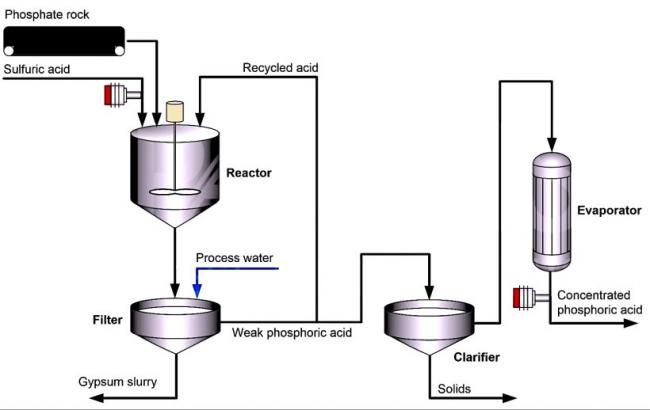
Затем добавляется обработанная вода, и гипс минерал из класса сульфатов, по составу гидрат сульфата кальция (CaSO4·2H2O) вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная этим мокрым способом, содержит 25-30% пятиокиси фосфора.
Обычно эта кислота дополнительно концентрируется, чтобы соответствовать требованиям, предъявляемым к производству удобрений вещества для питания растений и повышения плодородия почв. В большинстве большая часть чего-либо случаев фосфорная кислота концентрируется до 40-55% пятиокиси фосфора с помощью двух / трех вакуумных испарителей.
Здоровые альтернативы и рецепты
Газированные напитки, особенно Кола, являются основным способом потребления людьми фосфорной кислоты. Вместо этого употребление чистой газированной воды, такой как имбирный эль, может помочь сократить потребление. Однако, это все еще очень высокий вариант сахара, и есть лучшие альтернативы этим опасным для здоровья безалкогольным напиткам.
Если действительно нужно получить пузырьки, выбирайте натуральную газированную минеральную воду. Она дает газирование без каких — либо добавленных кислот, плюс вы получите полезные минералы в организм без перегрузки сахаром. Проверяйте этикетки перед употреблением, чтобы быть уверенными в ее натуральности.
Вы также можете попробовать сделать мой домашний рецепт свитча. Это легкий в приготовлении освежающий напиток, наполненный целебными ингредиентами, уменьшающим воспаление имбирем и яблочным уксусом.
Комбуча — еще одна замечательная альтернатива газировке. Вы получаете шипучие пузырьки (которые возникают в результате естественного брожения) вместе с мощным ударом пробиотиков, витаминов группы В и ферментов.
Вы также можете попробовать приготовить этот рецепт чайного гриба дома. Кокосовая вода — еще одна более здоровая альтернатива содовой, которая обеспечивает ценные электролиты.
Дифосфорная кислота (H
Простейшим из всех ПА является дифосфорная кислота (H 4 P 2 O 7 ), также известная как пирофосфорная кислота. Химическое уравнение его образования следующее:
2H 3 PO 4 <=> H 4 P 2 O 7 + H 2 O
Баланс зависит от количества воды и температуры. Какая у него структура? На изображении в разделе структуры ортофосфорной кислоты и пирофосфорной кислоты показаны в верхнем левом углу.
Две единицы ковалентно соединяются, когда молекула воды удаляется, образуя кислородный мостик P – O – P между ними. Теперь это не три кислых атома водорода, а четыре (четыре группы -ОН). Из-за этого H 4 P 2 O 7 имеет четыре константы ионизации k a .
Получение фосфорной кислоты
Химическое соединение имеет несколько способов производства. Известный промышленный метод изготовления кислоты ортофосфорной – термический, при котором получается чистый продукт высокого качества. Происходит такой процесс:
- окисление во время сжигания при избытке воздуха фосфора до фосфорного ангидрида, имеющего формулу Р4О10;
- гидратация, абсорбция полученного вещества;
- конденсация фосфорной кислоты;
- улавливание тумана из газовой фpaкции.
Есть еще две методики производства ортофосфорного соединения:
- Экстpaкционный способ, отличающийся экономичностью. Его основа – разложение природных минералов-фосфатов соляной кислотой.
- При лабораторных условиях вещество получается взаимодействием белого фосфора, являющегося ядовитым с разбавленной азотной кислоты. Процесс требует строгого соблюдения техники безопасности.
Правила работы с ортофосфорной кислотой
Как и любая другая кислота, ортофосфорная требует от человека предельной внимательности, аккуратности и выполнения всех правил безопасности при работе с кислотами.
Ортофосфорная кислота является довольно агрессивным химическим веществом при неправильном ее использовании и пренебрежение техникой безопасности применение ортофосфорного соединения может вызвать возникновение ожогов на кожных покровах. Пары фосфорной кислоты, могут спровоцировать ожоги слизистой дыхательных путей, а также проявление признаков серьезной интоксикации организма человека. Помимо этого, ортофосфорная кислота является пожаро- и взрывоопасным соединением
Именно поэтому весьма важно соблюдать предписанные правила при работе с фосфорной кислотой
Правила работы с ортофосфорной кислотой.
Работать с кислотой нужно только в условиях хорошо проветриваемого помещения.
При работе с кислотой, следует особое внимание уделить защитной экипировке в виде перчаток, маски или лучше респиратора и очков для защиты глаз.
Не допускать попадания кислоты на открытые участки тела, иначе могут возникнуть сильнейшие ожоги.
Если кислота, все же, попала на кожу, ее следует как можно скорее смыть большим количеством проточной воды и обязательно обратиться в больницу.
Транспортировка и хранение ортофосфорной кислоты также требует обязательного соблюдения определенных условий.
Хранить кислоту можно только в стеклянных емкостях, а также в полимерных сосудах и сосудах из нержавеющей стали.
Перевозить реагент разрешается только специальными автотрaнcпортными средствами, которые оснащены металлическими цистернами, не подвергающимися воздействию кислоты. Транспортировка допускается также и другими видами трaнcпорта, например, поездами или водными судами, но при условии полного соблюдения требований техники безопасности.
Условия хранения кислоты предусматривают ее помещение в такое место, куда не проникает солнечный свет. Хранить в таких условиях ортофосфорное соединение можно не более одного года.
Фосфаты — идеальный продукт для мясной промышленности
Между тем, мясная промышленность, будь то гамбургеры, колбасы или шашлык, любит фосфаты за их физико-химические свойства. Поскольку фосфаты позволяют удерживать воду в производимом продукте, они помогают белкам связывать больше воды, делая его более сочным после замораживания и разогрева.

Вода становится частью продукта и увеличивает конечный вес кусков мяса.
Однако фосфаты обеспечивают стабильность обработанного мяса, предотвращая его разрушение после обработки. Они надолго сохраняют цвет и вкус продукта. Прежде всего, делают его более привлекательным и аппетитным для потребителя.
Их используют и в других отраслях пищевой промышленности. Поскольку фосфаты позволяют сделать продукты более кремообразными, позволяют продуктам, которые обычно не тают, таять. И также предотвращают разделение напитков на отдельные ингредиенты. Эти добавки помогают выпечке подниматься, действуют как эмульгаторы в плавленом сыре. А также в пакетированных супах и кремах. Фосфаты продлевают срок хранения продуктов. Поэтому их добавляют, чтобы продлить срок хранения продуктов.









